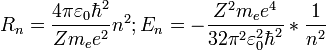- Модель атома Бора
-
Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка:
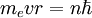 .
.Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения, для радиуса стационарной орбиты Rn и энергии электрона En на этой орбите находящегося:
Здесь me — масса электрона, Z — количество протонов в ядре,
 — электрическая постоянная, e — заряд электрона.
— электрическая постоянная, e — заряд электрона.Именно такое выражение для энергии можно получить, применяя чисто квантовомеханический подход, решая задачу о движении электрона в центральном кулоновском поле.
Радиус первой орбиты в атоме водорода R0=5.291772108(18)·10-11м, ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты E0=-13.6эВ представляет собой энергию ионизации атома водорода.
Wikimedia Foundation. 2010.