- Е514
-
Сульфат натрия 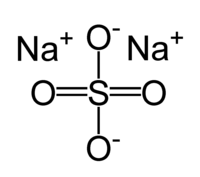

Общие Систематическое наименование сульфат натрия, сернокислый натрий Химическая формула Na2SO4 Отн. молек. масса 142,04 а. е. м. Молярная масса 142,04 г/моль Физические свойства Плотность вещества 2.68 г/см³ Состояние (ст. усл.) белые гигроскопичные кристаллы Термические свойства Температура плавления 884 °C Энтальпия (ст. усл.) -1387.9 кДж/моль Химические свойства Растворимость в воде 16,3 (20 °С), 29,8 (100 °C) г/100 мл Классификация номер CAS 7757-82-6 Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
Содержание
Свойства
Бесцветные кристаллы. Встречается в природе в виде минерала тенардита. Безводный Na2SO4 устойчив выше температуры 32,384 °С, ниже этой температуры кристаллизуется Na2SO4·10H2O.
Нахождение в природе
В природе кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
Сульфат натрия кристаллизуется в виде мирабилита.
Получение
Способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550°С; одновременно получается соляная кислота.
Применение
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств СМС, однако во многих странах в последние годы произошёл переход на на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России в 2008 году сульфат натрия по-прежнему присутствует практически во всех стиральных порошках, произведенных в стране (до трети по массе).
Второе по количеству применение сульфата натрия - стекольное производство. Также это вещество используют для получении сульфатной целлюлозы, в текстильной, кожевенной промышленности и в цветной металлургии, а также в медицине и ветеринарии (как слабительное средство и как добавка в средства промывания носа).
В небольших количествах сульфат натрия находит применение в химических лабораториях - в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
Зарегистрирован в качестве пищевой добавки E514.
См. также
Ссылки
Источники
- Реми Г. "Курс неорганической химии" т.2 М. 1966
Wikimedia Foundation. 2010.
