- Е507
-
 Модель молекулы соляной кислоты
Модель молекулы соляной кислотыСоля́ная (или соляна́я) кислота (хлористоводоро́дная кислота) (Hydrochloric acid) — HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.). Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см3. Слабые растворы соляной кислоты (до 0,4 %) имеют специфический терпко-кислый вкус, более концентрированные вызывают ожоги полости рта. Соли соляной кислоты называются хлоридами.
Содержание
Физические свойства
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
При 20 °C, 1 атм (101 kPa)Конц. (вес)
c : кг HCl/кгКонц. (г/л)
c : кг HCl/м³Плотность
ρ : кг/лМолярность
MpH Вязкость
η : мПа·сУдельная
теплоемкость
s : кДж/(кг·К)Давление
пара
PHCl : ПаТ
кипения
т.кип.Т
плавления
т.пл.10 % 104,80 1,048 2,87 M −0,5 1,16 3,47 0,527 103 °C −18 °C 20 % 219,60 1,098 6,02 M −0,8 1,37 2,99 27,3 108 °C −59 °C 30 % 344,70 1,149 9,45 M −1,0 1,70 2,60 1,410 90 °C −52 °C 32 % 370,88 1,159 10,17 M −1,0 1,80 2,55 3,130 84 °C −43 °C 34 % 397,46 1,169 10,90 M −1,0 1,90 2,50 6,733 71 °C −36 °C 36 % 424,44 1,179 11,64 M −1,1 1,99 2,46 14,100 61 °C −30 °C 38 % 451,82 1,189 12,39 M −1,1 2,10 2,43 28,000 48 °C −26 °C При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
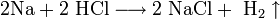
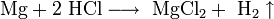
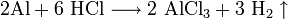
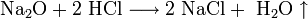
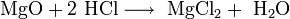
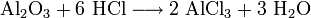
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
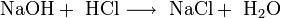
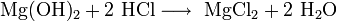
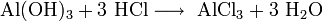
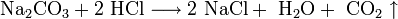
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
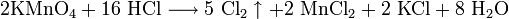
Производство
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород может быть получен путём взаимодействия концентрированной серной кислоты на хлорид натрия, или сжиганием водорода в атмосфере хлора.
Применение
Промышленность
- Применяют в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с ПАВ используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована в качестве регулятора кислотности, пищевой добавки E507. Применяется для изготовления зельтерской (содовой) воды.
Медицина
- Составная часть желудочного сока; разведенную соляную кислоту ранее назначали внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Особенности обращения

Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути.
Реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
Ссылки
- «Соляная кислота» на www.xumuk.ru
- Е-507. Соляная кислота, как пищевая добавка
- Соляная кислота - Применение в производстве.
Основные хлорсодержащие неорганические кислоты  Хлороводород(HCl)
Хлороводород(HCl) Хлорноватистая кислота (HClO)
Хлорноватистая кислота (HClO) Хлористая кислота (HClO2)
Хлористая кислота (HClO2) Хлорноватая кислота (HClO3)
Хлорноватая кислота (HClO3) Хлорная кислота (HClO4)
Хлорная кислота (HClO4)
Wikimedia Foundation. 2010.
