- Оксид азота(III)
-
Оксид азота(III) 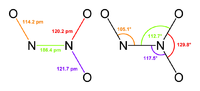
Общие Систематическое наименование Оксид азота(III) Химическая формула N2O3 Физические свойства Состояние (ст. усл.) бесцветный газ Молярная масса 76 г/моль Плотность 1.4·103 кг м−3, жидкость г/см³ Термические свойства Температура плавления −11 °C Температура разложения 4 °C Энтальпия образования (ст. усл.) 81 кДж/моль Химические свойства Растворимость в воде 0,01 г/100 мл Классификация Рег. номер CAS [10544-73-7] Оксид азота(III) (азотистый ангидрид, сесквиоксид азота) N2O3 — жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде.
Содержание
Получение
Рекомендуется капать 50%-ю азотную кислоту на твёрдый оксид мышьяка(III):
N2O3 образуется при охлаждении получающейся смеси газов.
При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета:
Также N2O3 можно получить действием 50%-ой азотной кислоты на крахмал:
Химические свойства
Кислотный оксид. N2O3 подвержен термической диссоциации:
При 25 °C содержание N2O3 в смеси газов составляет около 10,5 %. Жидкий оксид азота(III) синего цвета, он также частично диссоциирован.
Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту:
При взаимодействии с растворами щелочей образуются соответствующие нитриты:
Применение
Применяется в лаборатории для получения азотистой кислоты и её солей.
Физиологическое действие
Высоко токсичен. По действию на организм сравним с дымящей азотной кислотой. Вызывает тяжёлые ожоги кожи.
Оксиды азота  Оксид азота(I) (N2O)
Оксид азота(I) (N2O) Оксид азота(II) (NO)
Оксид азота(II) (NO) Оксид азота(III) (N2O3)
Оксид азота(III) (N2O3) Оксид азота(IV) (NO2)
Оксид азота(IV) (NO2) Оксид азота(V) (N2O5)
Оксид азота(V) (N2O5) Категория:
Категория:- Оксиды азота
-
Wikimedia Foundation. 2010.








