- Карбонилы металлов
-
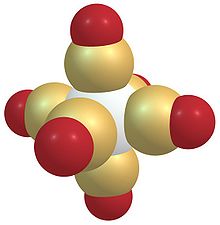
Карбонилы металлов — химические соединения, координационные комплексы монооксида углерода СО с переходными металлами общей формулой Mem(CO)n, например, карбонил железа — Fe(CO)5.
Содержание
История открытия
Первым (в 1890) был открыт карбонил никеля Ni(CO)4.
Строение карбонилов
Атом металла в карбониле находится в нулевой степени окисления. Карбонилы бывают одно-, двух- и многоядерными, при этом d-элементы с чётным числом валентных электронов образуют одноядерные, а с нечётным — двухъядерные карбонилы со связью металл-металл. Молекулы карбонилов элементов подгруппы хрома (Cr, Mo, W) имеют форму октаэдра с атомом металла в центре.
Свойства карбонилов
Карбонилы никеля, железа, осмия, рутения — жидкости; большинство других — кристаллические вещества. Карбонилы диамагнитны, весьма летучи, чрезвычайно токсичны, хорошо растворимы в органических растворителях, но, как правило, плохо растворимы в воде. При нагревании выше определённой температуры карбонилы разлагаются с выделением угарного газа и металла в мелкодисперсном состоянии.
Физические свойства некоторых карбонилов металлов Карбонил металла Цвет tпл, °C tкип, °C Плотность (при 20 °C), г/см³ V(CO)6 зелёно-голубой разлагается — Cr(CO)6 бесцветный 150 разлагается 1,77 Mn2(CO)10 жёлтый 157 возгоняется 1,75 Fe(CO)5 жёлтый −20 103 1,455 Fe2(CO)9 оранжевый разлагается 2,85 Fe3(CO)12 тёмно-зелёный 165 разлагается Со2(СО)8 оранжево-красный 51 разлагается 1,87 Со4(СО)12 чёрный разлагается Ni(CO)4 бесцветный −19,3 43 1,31 Mo(CO)6 бесцветный 150 разлагается 1,96 Tc2(CO)10 бесцветный 160 Ru(CO)5 бесцвеный −22 Ru3(CO)12 оранжевый 155 Rh2(CO)8 оранжевый 76 Rh4(CO)12 красный W(CO)6 бесцветный 150 разлагается 2,65 Re2(CO)10 бесцветный 177 разлагается 2,87 Os(CO)5 бесцветный −15 Os3(CO)12 жёлтый 224 разлагается Ir2(CO)8 зелёно-жёлтый разлагается — Ir4(CO)12 жёлтый Способы получения
Общий способ получения карбонилов металлов заключается во взаимодействии окиси углерода с металлами или их солями при повышенных температурах и давлении. В частности, для получения Fe(CO)5 необходимы температура порядка 180—220 °C и давление 1·107-2·107 Па; для Co2(CO)8 — 150—200 °C и 2,5·107 Па; сравнительно легко можно получить тетракарбонил никеля Ni(CO)4, образующийся уже при 60-80 °C.
Применение
Наибольшее техническое значение имеют карбонилы никеля Ni(CO)4, кобальта Со2(СО)8 и железа Fe(CO)5. Карбонилы применяют для получения чистых металлов, образующихся при их термическом разложении. Термическое разложение карбонилов кобальта, никеля и хрома используется для нанесения металлических покрытий, особенно на поверхности сложной формы. Карбонилы кобальта и никеля применяются в качестве катализаторов важных химических процессов, используют при синтезе карбоновых кислот и их производных из олефинов, акриловой кислоты из ацетилена, при гидроформилировании.
Лёгкость образования тетракарбонила никеля используется для разделения кобальт-никелевых смесей, поскольку для получения Co2(CO)8 необходимы более высоокие температуры и давления. Также высокой степени разделения никеля и кобальта удаётся достичь разгонкой смесей их карбонилов, так как летучесть последнего значительно меньше.
Карбонилы металлов — хорошие антидетонаторы моторного топлива, однако при их сгорании образуются трудноудаляемые оксиды. Некоторые карбонилы используются для получения абсолютно чистого оксида углерода (II).
Оксиды углерода Оксиды CO2 · CO 
Экзотические оксиды Угольная кислота · Гидрокарбонаты · Карбонаты · Дикарбонаты · Трикарбонаты Категории:- Соединения углерода
- Комплексные соединения
- Координационная химия
Wikimedia Foundation. 2010.