- ТИОКАРБОНОВЫЕ КИСЛОТЫ
аналоги карбоновых к-т, в к-рых один атом кислорода замещен на атом серы. Существуют в виде смеси таутомерных тиоловых RC(O)SH и тионовых RC(S)OH к-т с преобладанием первых. В твердом состоянии и в концентрир. р-рах благодаря образованию водородных связей Т. к. образуют димеры.
Низшие Т. к.-желтоватые жидкости с неприятным запахом. У тиомуравьиной к-ты при т-ре выше 30 °С появляется тенденция к полимеризации, другие Т. к. термически очень стабильны.
Т. к.-более "сильные к-ты, чем соответствующие карбо-новые к-ты; При диссоциации образуют тиокарбоксилат-анион. Легко гидролизуются (особенно в присут. кислых или основных катализаторов) с образованием карбоновых к-т и H2S.
Т. к.-эффективные ацилирующие агенты, превращают спирты в сложные эфиры, меркаптаны-в эфиры тиолкар-боновых к-т (S-эфиры), амины-в амиды. В среде сверхкислот при Ч 70°С Т. к. протонируются по атому кислорода с образованием соответствующих карбениевых ионов; при повышении т-ры до Ч 10-0°С образуются ацилиевые ионы:
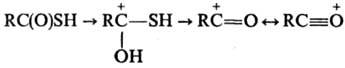
Алкилирование Т. к. алкилгалогенидами в присут. оснований или спиртами (по Мицунобу реакции) приводит к образованию S-эфиров, взаимодействие Т. к. с триалкилхлорсиланами или гексаметилдисилазаном-к образованию О-три-алкилсилиловых эфиров, напр.:
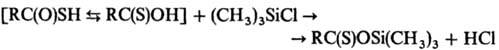
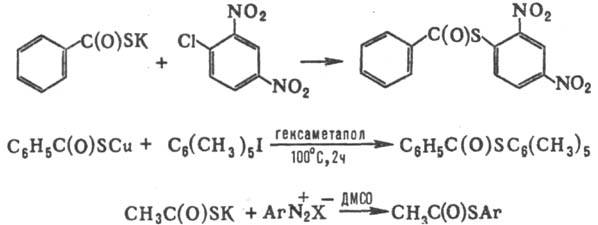
При арилировании Т. к. активир. арилгалогенидами, в условиях р-ции Ульмана или солями диазония образуются S-ариловые эфиры, напр.:
Т. к. присоединяются к неактивир. алкенам и алкинам по радикальному механизму против правила Марковникова с образованием соотв. S-алкиловых и S-алкениловых эфиров. Гидролиз S-эфиров Т. к., полученных указанными выше способами,-удобный способ получения алкил- и арилмер-каптанов.
Эфиры тионкарбоновых к-т (О-эфиры) получают либо из производных карбоновых к-т (напр., взаимод. эфиров с P4S10 или реагентом Лавессона-продуктом р-ции анизола с P2S5, имидоэфиров с H2S), либо присоединением спиртов к тиокетенам.
Р-ция Т. к. с альдегидами приводит к дитиоацилалям (р-ция 1), с нитрилами-к тиоамидам (2), с тиоцианатами-к S-эфирам (3), с изотиоцианатами-к амидам (4), напр.:
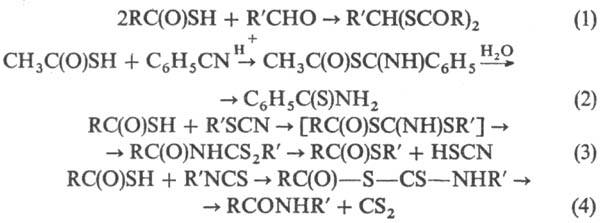
При взаимодействии Т. к. с хлорангидридами карбоновых к-т образуются симметричные и несимметричные диацил-сульфиды, при окислении мягкими окислителями (напр., иодом) - диацилдисульфиды.
Получают Т. к. взаимод. магнийорг. соед. с COS (р-ция 5); действием оснований (NaH, диазабициклоундецен-ДБУ) и COS на соед. с активной метиленовой или метальной группой; взаимод. Р 4S10 с карбоновыми к-тами; р-цией H2S или NaSH с хлорангидридами, ангидридами и эфирами карбоновых к-т; взаимод. CS2 с Na-солями амидов к-т (6, 7); присоединением H2S или Н 2 О к кетенам или тиокетенам (8, 9):
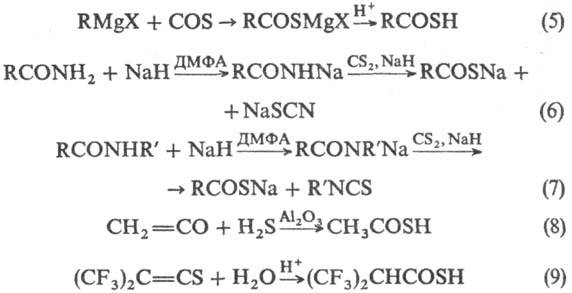
Т. к. могут быть выделены из их производных, напр. действием H2S на S-эфиры в присут. третичных аминов.
Т. к. применяют в качестве ацилирующих агентов. Так, S-эфиры были использованы при полном синтезе макролид-ных антибиотиков, кофермента А, в пептидном синтезе, Т. к.-заменители H2S в аналит. химии.
См. также Дитиокарбоновые кислоты, Тиоуксусная кислота.
Лит.: Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 621-36; Houben-Wcyl, Methoden der organischen Chemie, Bd E 5, Tl 1, Stuttg.-N. Y., 1985, S. 832-90, 785-812. B.H. Дрозд.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
