- Рицин
-
Рицин Общие Термические свойства Безопасность ЛД50 0,3 мг/кг Токсичность СДЯВ  Семена клещевины — источник рицина
Семена клещевины — источник рицина
Рици́н — белковый токсин растительного происхождения, для человека средняя смертельная доза (LD50) — 0,3 мг/кг[1] перорально.
Рицин представляет собой белый порошок без запаха, хорошо растворимый в воде.
Рицин не проникает через кожу. Пути отравления — обычно введение в кровь, чуть хуже проникновение через легкие (этот метод для рицина не всегда эффективен). Основной путь отравления — с пищей.
Содержание
Биохимия
Механизм токсического действия рицина включает ингибирование синтеза белка рибосомами. Известны два основных типа таких ингибиторов: ингибиторы типа 1 представляют собой единичную полипептидную цепь, обладающую ферментативной активностью, а рицин и прочие ингибиторы типа 2 состоят из двух полипептидных цепей и являются гетеродимерными гликопротеинами. Из них только цепь А обладает ферментативной активностью, а цепь В, связанная с нею дисульфидными связями, проявляет активность, свойственную лектинам и опосредует проникновение токсина в цитозоль. Чтобы токсин мог инактивировать рибосому, дисульфидная связь между цепями А и В должна быть восстановлена[2].
Структура
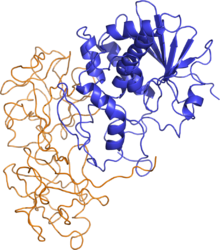
Молекула рицина представляет собой гликозилированный глобулярный гетеродимер массой 60-65 кДа. Массы цепей А и В приблизительно равны: 32 и 34 кДа соотв.
- Цепь А - N-гликозидаза, состоит из 267 аминокислотных остатков[3]. Три структурных домена, состоящие из альфа-спиралей и бета-складок, образуют щель, в которой расположен активный центр[4].
- Цепь B - лектин, состоит из 262 аминокислотных остатков, связывает остатки галактозы на поверхности клетки[5]. Образует двудольную структуру, лишенную альфа-спиралей и бета-складок, каждая доля разделяется на три субдомена, один из которых содержит активный центр. Белки, подобные цепи А, содержат многие растения, например, ячмень, но в отсутствие цепи В они не токсичны.
Проникновение в цитозоль
Способность рицина проникать в цитозоль зависит от водородных связей, образующихся между аминокислотными остатками цепи В и олигосахаридами на поверхности клетки, содержащими остатки галактозы или N-ацетилгалактозамина. Кроме того, остатки маннозы, входящие с состав рицина, могут связываться рецепторами маннозы на поверхности клетки[6]. Показано, что на поверхности одной клетки может связаться до 106-108 молекул рицина[7]. После связывания происходит интернализация молекул как в клатриновые везикулы, так и в транспортные везикулы, не содержащие клатрин, такие как кавеолы и везикулы, образующиеся при макропиноцитозе[8][9]. Так рицин попадает в эндосомы и затем в аппарат Гольджи. Хотя на этом пути рицин проходит через лизосомы, он не подвергается деградации[10], и из аппарата Гольджи попадает в эндоплазматический ретикулум интактным.
Известно, что для проявления токсической функции рицин должен распасться на А- и В-цепи, но где это происходит, в эндоплазматическом ретикулуме или в цитозоле, пока неизвестно[11]. Существующий в цитозоле механизм очистки от лишнего белка путем его убиквитинирования на рицин также не действует, поскольку для присоединения убиквитина в его структуре не хватает остатков лизина[12].
Инактивация рибосомы
Показано, что цепь А расщепляет гликозидную связь при остатке аденина в позиции 4324 рРНК 28S субъединицы[13][14]; этот остаток расположен в консервативной последовательности 5’-AGUACGAGAGGA-3’, называемой сарцин-рициновой петлей, которая важна для связывания факторов элонгации[15], вследствие чего синтез белка на рибосоме полностью и необратимо блокируется. На этом действие цепи А не прекращается, каждая молекула этого фермента выводит из строя до 1500 рибосом в минуту.
Производство
Рицин получают из касторовых бобов, плодов растения Ricinus communis (русское название клещевина) путем обработки жмыха, остающегося после получения касторового масла (также содержащего следы рицина).
Применение
Медицина
В отличие от касторового масла, очищенный рицин в медицине не применяется, хотя проводились разработки способов его использования для лечения рака, а также при вакцинации.
Химическое оружие
Способы применения рицина в качестве оружия массового поражения изучались военными ведомствами разных стран, начиная с Первой мировой войны, однако из-за ряда недостатков это вещество так и не было принято на вооружение. Тем не менее, рицин нашёл применение у спецслужб. Одним из наиболее известных инцидентов с применением рицина стало убийство болгарского диссидента Георгия Маркова, который был отравлен в 1978 году при помощи укола зонтиком особой конструкции.[16]
Простота получения токсина сделала его потенциально доступным для террористических групп. Так, в 2001 году пресса сообщала об обнаружении инструкций по изготовлению рицина на разгромленной базе «Аль-Каида» в Кабуле.[17] В 2003 году некоторое количество рицина было найдено у террористов в Лондоне[18], следы рицина обнаружились в ячейке хранения на Лионском вокзале в Париже[19].
Примечания
- ↑ Статья о рицине в химической экциклопедии
- ↑ Wright HT, Robertus JD (1987). «The intersubunit disulfide bridge of ricin is essential for cytotoxicity». Arch Biochem Biophys 256: 280–4. DOI:10.1016/0003-9861(87)90447-4.
- ↑ Olnes S, Pihl A (1973). «Different biological properties of the two constituent peptide chains of ricin, a toxic protein inhibiting protein synthesis». Biochemistry 12: 3121–26. DOI:10.1021/bi00740a028.
- ↑ Weston SA, Tucker AD, Thatcher DR, et al. (1994). «X-ray structure of recombinant ricin A-chain at 1.8 A resolution». J Mol Biol 244: 410–22. DOI:10.1006/jmbi.1994.1739.
- ↑ Wales R, Richardson PT, Robers LM, Woodland HR, et al. (1991). «Mutational analysis of the galactose binding ability of recombinant ricin b chain». J Biol Chem 266: 19172–79.
- ↑ Magnusson AS, Kjeken R, Berg T (1993). «Characterization of two distinct pathways of endocytosis of ricin by rat liver endothelial cells». Exp Cell Res 205: 118–25. DOI:10.1006/excr.1993.1065.
- ↑ Sphyris N, Lord JM, Wales R, et al. (1995). «Mutational analysis of the ricinus lectin b-chains: Galactose-binding ability of the gamma subdomain of ricinus communis agglutin b-chain». J Biol Chem 270: 20292–97. DOI:10.1074/jbc.270.35.20292. PMID 7657599.
- ↑ Moya M, Dautry-Varsat A, Goud B, et al. (1985). «Inhibition of coated pit formatin in Hep2 cells blocks the cytotoxicity of diphtheria toxin but not that of ricin toxin». J Cell Biol 101: 548–59. DOI:10.1083/jcb.101.2.548. PMID 2862151.
- ↑ Nichols, BJ, Lippincott-Schwartz J (2001). «Endocytosis without clathrin coats». Trends Cell Biol 11: 406–12. DOI:10.1016/S0962-8924(01)02107-9.
- ↑ Lord MJ, Jolliffe NA, Marsden CJ, et al. (2003). «Ricin Mechanisms of Cytotoxicity». Toxicol Rev 22 (1): 53–64. DOI:10.2165/00139709-200322010-00006.
- ↑ Roberts LM, Smith DC (2004). «Ricin: the endoplasmic reticulum connection». Toxicon 44: 469–72. DOI:10.1016/j.toxicon.2004.07.002.
- ↑ Deeks ED, Cook JP, Day PJ, et al. (2002). «The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol». Biochemistry 41: 3405–13. DOI:10.1021/bi011580v.
- ↑ Endo Y, Tsurugi K (1987). «RNA N-glycosidase activity of ricin A-chain: mechanism of action of the toxic lectin ricin on eukaryotic ribosomes». J Biol Chem 262: 8128–30.
- ↑ Endo Y, Tsurugi K (1998). «The RNA N-glycosidase activity of ricin A chain». J Biol Chem 263: 8735–9.
- ↑ Sperti S, Montanaro L, Mattioli A, et al. (1973). «{{{title}}}». Biochem J 136: 813–5.
- ↑ Rózsa L, Nixdorff K 2006. Biological Weapons in Non-Soviet Warsaw Pact Countries. pp. 157—168. In: Wheelis M, Rózsa L, Dando M (eds.) 2006. Deadly Cultures: the History of Biological Weapons since 1945. Harvard University Press.
- ↑ Бин Ладен «создает яд рицин» // Русская служба Би-би-си. 16 ноября 2001 г.
- ↑ В Лондоне нашли смертельно опасный яд // Русская служба Би-би-си. 7 января 2003 г.
- ↑ На вокзале в Париже обнаружен рицин // Русская служба Би-би-си. 21 марта 2003 г.
Ссылки

В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 14 мая 2011.Белки: альбумины Яичный белок Кональбумин - Овальбумин - Авидин Сывороточный альбумин Сывороточный альбумин человека - Бычий сывороточный альбумин - Транстиретин Другое C-реактивный белок - Лактальбумин (Альфа-лактальбумин) - Парвальбумин - Рицин Категории:- Белковые токсины
- Химическое оружие
Wikimedia Foundation. 2010.