- Электрофорез белков в ПААГ
-
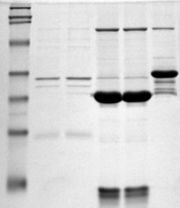 Фотография полиакриламидного геля, иллюстрирующая разделение белков по молекулярной массе. Маркеры на левой дорожке
Фотография полиакриламидного геля, иллюстрирующая разделение белков по молекулярной массе. Маркеры на левой дорожкеЭлектрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE, sodium dodecyl sulfate polyacrylamide gel electrophoresis) — это методика разделения белков в соответствии с их электрофоретической подвижностью (функцией длины полипептидной цепочки или молекулярной массы, а также укладки белковой молекулы, посттрансляционных модификаций и других факторов). Электрофорез в полиакриламидном геле широко применяют в современной молекулярной биологии, биохимии, генетике.
Содержание
Механизм разделения белков
Элетрофоретическая подвжность биополимеров в геле зависит от ряда параметров. Скорость миграции пропорциональна заряду молекулы, и в свободной жидкости молекулы с одинаковым удельным зарядом мигрируют с равной скоростью. В случае разделения в среде, имеющей жесткую пространственную матрицу, происходит сегрегация за счет трения о гель. Сила трения зависит от пространственной конфигурации молекулы, в том числе от её размера. Таким образом, в случае электрофоретического разделения нативных белков будет наблюдаться сложная картина их распределения в зависимости от вышеприведенных факторов.
В 1970 году en:Laemmli для изучения процесса сборки капсида бактериофага Т4 предложил метод электрофоретического разделения белков в полиакриламидном геле в зависимости от молекулярной массы [1]. Для этого перед нанесением на форез образцы кипятили в присутствии додецилсульфата натрия (детергентом, его молекула состоит из двенадцатичленной алифатической неразветвленной цепи и ковалентно связанного с ним сульфата, имеющего в растворе отрицательный заряд.
При использовании описываемого метода исходят из следующих допущений:
- белки после обработки
- количество молекул
- собственный заряд полипептида несущественен в сравнении с зарядом связанного с ним
SDS-PAGE по Лэммли
Для проведения денатуририрующего электрофореза в ПААГ используют гель, состоящий из двух частей. Концентрирующий гель имеет pH 6,5 и концентрацию полиакриламида около 4 %. Разделяющий гель имеет рН в районе 8,5-9 и концентрацию полиакриламида 10-20 %. Все буферы не содержат неорганических солей, основным переносчиком тока в них является глицин. При рН 6,5 суммарный заряд молекулы глицина близок к нулю. Вследствие этого для переноса определенного заряда (который определяется силой тока в электрофоретической ячейке), отрицательно заряженные комплексы полипептидов с SDS должны двигаться с большой скоростью. При рН 8,8 глицин приобретает отрицательный заряд, вследствие чего на границе концентрирующего и разделяющего гелей белки резко тормозятся (в переносе одинакового заряда через единицу площади теперь участвует гораздо больше заряженных молекул, следовательно, они двигаются с меньшей скоростью). Результатом этого является концентрирование белков на границе гелей, что очень сильно повышает разрешающую способность метода.
В разделяющем геле белки мигрируют в зависимости от длины полипептидной цепи, то есть пропорционально молекулярной массе.
Визуализация продуктов разделения
Для визуализации результатов электрофореза чаще всего используют окрашивание гелей красителем Кумасси (en:Coomassie blue) или серебром. Для проведения Western-гибридизации белки электрофоретически переносят из геля на нитроцеллюлозную мембрану.
См. также
- ДНК электрофорез
- Изотахофорез
- Капиллярный электрофорез
Ссылки
- ↑ U. K. Laemmli. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature,1970; V.227, P.680 — 685
- Остерман Л. А. Методы исследования белков и нуклеиновых кислот: Электрофорез и ультрацентрифугирование (практическое пособие). М.: Наука, 1981. 288 с.
- Д. Кларк, Л. Рассел
Молекулярная биология: простой и занимательный подход. Глава 16 (Методы молекулярной биологии). http://kondcom.narod.ru/Glava16.pdf
- количество молекул
- белки после обработки
Wikimedia Foundation. 2010.
