- Молярная концентрация
-
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
Массовая доля (также называют процентной концентрацией)
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
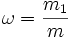 ,
,где:
- m1 — масса растворённого вещества, г (кг);
- m — общая масса раствора, г (кг).
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят 2 измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в аккумуляторных) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
Пример. Зависимость плотности растворов H2SO4 от её массовой доли в водном растворе при 20°C ω, % 5 10 15 20 30 40 50 60 70 80 90 95 ρ H2SO4, г/мл 1,032 1,066 1,102 1,139 1,219 1,303 1,395 1,498 1,611 1,727 1,814 1,834 Объёмная доля
Объемная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
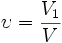 ,
,где:
- V1 — объём растворённого вещества, л;
- V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров.
Молярность (молярная объёмная концентрация)
Молярная концентрация — число молей растворённого вещества в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м3, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации- С(х), которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
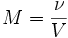 ,
,где:
- ν — количество растворённого вещества, моль;
- V — общий объём раствора, л.
Моляльность (молярная весовая концентрация)
Моляльность — число молей растворённого вещества в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
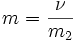 ,
,где:
- ν — количество растворённого вещества, моль;
- m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность - величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль/л, называют децинормальным и записывают как 0,1 н.
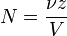
где:
- ν — количество растворённого вещества, моль;
- V — общий объём раствора, л;
- z — фактор эквивалентности.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата KHSO4, и двухнормальным в реакции с образованием K2SO4.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
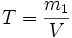 ,
,где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
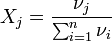 ,
,где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, т.к. при этом изменяется плотность растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т.п.
Формулы перехода от одних выражений концентраций растворов к другим
Наиболее распространённые единицы
Часто используемые единицы Измеряемая величина Запись Формула Типичная единица Атомный процент (A) at.% 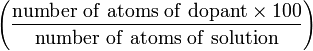
% Атомный процент (B) at.% 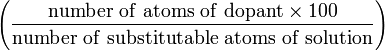
% Массовый процент wt% 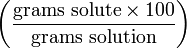
% Mass-volume percentage - 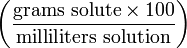
% though strictly %g/mL Volume-volume percentage - 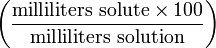
% Молярность M 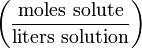
mol/L (or M or mol/dm3) Molinity - 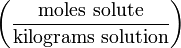
mol/kg Моляльность m 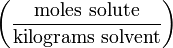
mol/kg (or m**) Мольная доля Χ (chi) 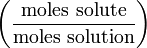
(decimal) Formal F 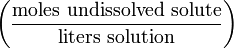
mol/L (or F) Нормальность N 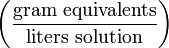
N Частей на сто (Parts per hundred) % (or pph) 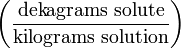
da.g/kg Частей на тысячу (Parts per thousand) ‰ (or ppt*) 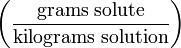
g/kg Частей на миллион ppm 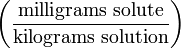
mg/kg Частей на миллиард (Parts per billion) ppb 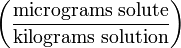
µg/kg Parts per trillion ppt* 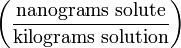
ng/kg Parts per quadrillion ppq 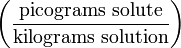
pg/kg
Wikimedia Foundation. 2010.
