- ДЮФУРА ЭФФЕКТ
- ДЮФУРА ЭФФЕКТ
-
(диффузионная теплопроводность), возникновение разности темп-р в результате диффузионного перемешивания двух химически невзаимодействующих газов или жидкостей, первоначально находящихся при одинаковой темп-ре. Эффект, обратный термодиффузии. В газах разность темп-р при Д. э. может достигать неск. К (напр., при смешивании водорода и азота), в жидкостях — она =10-3 К. Разность темп-р сохраняется, если поддерживается градиент концентраций. Впервые наблюдался в 1873 швейц. физиком Л. Дюфуром (L. Dufour).
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ДЮФУРА ЭФФЕКТ
-
(термодиффузионный эффект) - появление теплового потока вследствие градиента концентрации в бинарной системе газов или жидкостей. Необратимый процесс, обратный термодиффузии. Открыт Л. Дюфуром (L. Dufour) в 1872, подробно исследован К. <Клузиусом(К. <Сlusius) и Л. Вальдманом(L. Waldmann) в 1942-49. Тепловой поток Jq, возникающий при пост. давлении вследствие градиента концентрации nc1 и темп-ры n Т, равен:
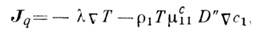
где l - коэф. теплопроводности, D " - коэф. Дюфура, r1 - плотность первого компонента, (mc11=( дm1/ дc1)T,(m1 - хим. потенциал первого компонента. Появление производной хим. потенциала по концентрации связано с тем, что в линейных соотношениях Онсагера (см. Онсагера теорема )термодинамич. силы пропорц. градиентам хим. потенциалов. Величину b = r1Tmc11D " называют коэф. диффузионного термоэффекта. <Кроме теплового потока в такой бинарной системе возникает и поток массы (диффузия):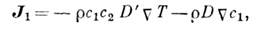
где D' - коэф. термодиффузии, D - коэф. диффузии; величина KT = c1c2TD'/D наз. термодиффузионным отношением. Д. э. и перенос массы наз. перекрёстными процессами. Согласно теореме Онсагера, коэф. Дюфура и коэф. термодиффузии равны: D "=D' (соотношение Онсагера). Значения коэф. Дюфура (и соответственно коэф. термодиффузии) могут быть как положительными, так и отрицательными, но при этом всегда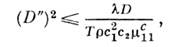
что следует из положительности производства энтропии и условия термодинамич. устойчивости. В стационарном состоянии, когда диффузионный поток обращается в нуль,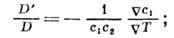
это отношение наз. коэффициентом Соре и в жидких и газовых смесях имеет порядок величины 10-3-10-5 К -1. Т. о., зная значение D, можно определить D', а следовательно, и D ". Для жидкостей D "~10-8- 10-10 см/с-К, для газов D "~10-4- 10-6 см 2/с-К. <Коэф. D " можно измерить и непосредственно поградиенту темп-ры, возникающему при смешивании разл. жидкостей или газов: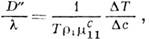
где DT - макс. разность темп-р разл. жидких или газообразных веществ, имевших до смешивания одинаковую темп-ру. В газах DT порядка неск. К, а жидкостях в 104 раз меньше. Эти результаты подтверждают соотношение Онсагера. Лит.: Гроот С. д е, Мазур П., Неравновесная термодинамика, пер. с англ., М., 1964, гл. 11: X а а з е Р., Термодинамика необратимых процессов, пер. с нем., М., 1907, гл. 4. Д. Н. Зубарев.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
