- ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
- ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
-
(металлические соединения, металлиды) - в узком смысле кристаллы, представляющие собой соединения металлов друг с другом; в широком смысле двух- или многокомпонентные кристаллы, электронное строение к-рых имеет характерные признаки металла (или полупроводника). Кристаллич. структуры И. с. отличаются от структуры отд. компонент. <И. с. формируются из жидких, жидкой и твёрдой, твёрдых фаз, а также из неупорядоченного твёрдого раствора. В последнем случае они наз. фазами Куркакова. Кристаллич. структура И. с. устойчива в огранич. областях изменения состава, темп-ры
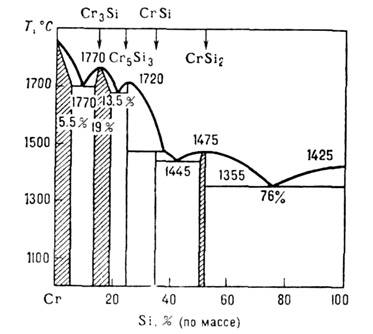
Диаграмма состояния системы Cr-Si; заштрихованы концентрационные области гомогенности. <и давления (области гомогенности). Напр., диаграмма состояния системы Сr-Si (рис.) иллюстрирует образование И. с.: Cr3Si, Cr5Si3, CrSi, CrSi2, причём первое и последнее из них отличаются протяжёнными концентрац. областями гомогенности. В И. с. существуют равновесные точечные дефекты типа атомов замещения, внедрения или вакансий, концентрация к-рых больше, чем в однокомпонентных кристаллах. В нек-рых И. с., напр. VH1_x, TiC1_x, Ni1-xAl, a-Fе 1_xSi2, концентрация вакансии достигает десятков % от числа узлов решётки. <По атомно-кристаллич. и электронному строению различают след, классы И. с.: электронные соединения (фазы Юм - Розери), фазы Лавеса (Cu2Mg,MgZn2, MgNi2), фазы внедрения (гидриды, карбиды, нитриды металлов), И. с. переходных d -металлов друг с другом (s-фазы), И. с. d- и f -металлов о непереходными элементами и др. Электронными соединениями являются, напр., фазы системы Сu-Zn: CuZn (b-фаза), Cu5Zn3 (g-фаза), CuZn3 (e-фаза). Их кристаллич. структура и состав определяются гл. обр. электронной концентрацией, к-рая для перечисленных И. с. близка к 3/2, 31/13, 7/4 (отношение числа валентных электронов к числу атомов). Эти значения соответствуют размерам ферма-поверхности, при к-рых она касается границ первой Бриллюэна зоны для соответствующих кристаллич. структур. Для электронного строения таких И. с. характерно расположение уровня Ферми в энергетич. зоне, образованной s состояниями (зона s-типа), и приблизительная сферичность поверхности Ферми. <Фазы Лавеса характеризуются плотными упаковками с чередованием шаровых слоев, напр. АВСАВС, АВАВАВ и АВАСАВАС. Идеальное отношение атомных диаметров 1,225 (у большинства соединений 1,1-1,6). Области гомогенности фаз Лавеса незначительны. <Фазы внедрения имеют простые структуры (объёмно центрированная кубич., гранецентрированная и др.), образуются из компонентов, для к-рых отношение атомных диаметров меньше 0,59. Области гомогенности обычно широкие за счёт того, что часть междоузлий матрицы может оставаться незанятой атомами компонента с меньшим атомным диаметром. Для электронного строения карбидов и нитридов переходных металлов характерно формирование энергетич. подзон из s и р -состояний, генетически связанных с атомами С и N, в низко-энергетич. части электронного спектра и расположение уровня Ферми в области d -состояний переходного металла. Межатомное взаимодействие сильное. <В И. с. d- и f -металлов с непереходными элементами (В, Al, Ga, Si, Ge и др.) межатомное взаимодействие также велико. Т. к. атомы переходных металлов имеют ближайшими соседями атомы непереходных элементов, то часть d-, f -состояний остаётся не вовлечённой в межатомные связи и формирует узкие подзоны в высокоэнергетич. части электронного спектра. Степень заполнения таких подзон электронами определяет плотность состояний на уровне Ферми и физические свойства И. с. <Разнообразие свойств И. с. обеспечивает их практич. использование. Среди И. с. есть сверхпроводники(V3Si, Nb3Ge, Nb3Sn и др.), полупроводники и полуметаллы(GaAs, HgTe, CrSi2, CoB, Mg2Sn и др.), ферромагнетики(SmCo, CoPt и др.), кристаллы с высокими термоэмиссионными свойствами (LaB6). Нек-рые И. с. обладают высокой твёрдостью (WC, TiB2, TiC), жаростойкостью (MoSi2, TiB2), a TaC - высокой темп-рой плавления. Лит.: Гельд П. В., Сидоренко Ф. А., Силициды переходных металлов четвертого периода, М., 1971; Мелихов В. Д., Пресняков А. А., Строение и свойства электронных фаз, А.-А., 1973; Тейлор К., Интерметаллические соединения редкоземельных металлов, пер. с англ., М., 1974; Крипякевич П. И., Структурные типы интерметаллических соединений, М., 1977; Андриевский Р. А., Уманский Я. С., Фазы внедрения, М., 1977; Гладышевский Е. И., Бодак О. И., Кристаллохимия интерметаллических соединений редкоземельных металлов, Львов, 1982; Кузьма Ю. Б., Кристаллохимия боридов, Львов, 1983; Свойства, получение и применение тугоплавких соединений. Справочник, под ред. Т. Я. Косолаповой, М., 1986.П. В. Гелъд, Ф. А. Сидоренко.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
