- ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ
- ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ
-
одно из первых уравнений состояния реального газа. Предложено в 1873 голл. физиком Я. Д. Ван-дер-Ваальсом (J. D. van der Waals). Для моля газа, имеющего объём V при темп-ре Т и давлении р, имеет вид:(p+a/V2)(V-b)=RT,где R — универсальная газовая постоянная, а a и b — эксперим. константы, учитывающие отклонение св-в реального газа от св-в идеального. Так, член a/V2 имеет размерность давления и учитывает притяжение молекул в результате межмолекулярного взаимодействия, а константа b — поправка на собств. объём молекул, учитывающая отталкивание молекул на близких расстояниях. При больших V (а также для разреж. газов) константами а и & можно пренебречь и В. у. переходит в ур-ние состояния идеального газа (см. КЛАПЕЙРОНА УРАВНЕНИЕ).В. у. явл. приближённым и количественно определяет св-ва реальных газов лишь в области высоких Т и низких р. Однако качественно оно позволяет описывать поведение газа при высоких р, конденсацию газа и критич. состояние.На рисунке приведены изотермы, рассчитанные по В. у. При низких Т все три корня В. у.— действительные, а выше критич. темп-ры (Тк) остаётся лишь один действит. корень. Это означает, что при Т>ТК в-во может находиться только в одном (газообразном) состоянии, а при Т<ТК — в трёх состояниях (двух стабильных — жидком Vж и газообразном Vг — и одном нестабильном). Точки прямой ас отвечают равновесию жидкости и её насыщ. пара. В условиях равновесия, напр. в состоянии, соответствующем точке b, относит, кол-ва жидкости и пара определяются отношением отрезков вс/ва («правило моментов»). Равновесию фаз при определ. Т соответствует давление насыщ. пара рнп и интервал объёмов отVж до Vr.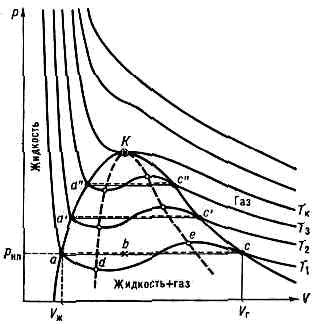 Диаграмма состояния в-ва в координатах р — V: T1, Т2, Т3, Тк — изотермы, рассчитанные по ур-нию Ван-дер-Ваальса; К — критич. точка. Линия dKe (спинодаль) очерчивает область неустойчивых состояний.При более низких р (за областью, где возможно одновременное существование газа и жидкости) изотерма характеризует св-ва газа. Левая, почти вертик. часть изотермы отражает малую сжимаемость жидкости. Участки ad и еc (и аналогичные участки др. изотерм) относятся соотв. к перегретой жидкости и переохлаждённому пару (метастабильные состояния). Участок de физически неосуществим, т. к. здесь происходит увеличение V при увеличении р. Совокупность точек а, а', а" и с, с', с", . . . определяет кривую, наз. бинодалью, к-рая очерчивает область совместного существования газа и жидкости. В критич. точке К параметры Тк, рк и Vк имеют значения, характерные для данного в-ва. Однако если в В. у. ввести относит. величины Т/Тк, р/рк и V/VK, то можно получить т. н. приведённое В. у., к-рое явл. универсальным.
Диаграмма состояния в-ва в координатах р — V: T1, Т2, Т3, Тк — изотермы, рассчитанные по ур-нию Ван-дер-Ваальса; К — критич. точка. Линия dKe (спинодаль) очерчивает область неустойчивых состояний.При более низких р (за областью, где возможно одновременное существование газа и жидкости) изотерма характеризует св-ва газа. Левая, почти вертик. часть изотермы отражает малую сжимаемость жидкости. Участки ad и еc (и аналогичные участки др. изотерм) относятся соотв. к перегретой жидкости и переохлаждённому пару (метастабильные состояния). Участок de физически неосуществим, т. к. здесь происходит увеличение V при увеличении р. Совокупность точек а, а', а" и с, с', с", . . . определяет кривую, наз. бинодалью, к-рая очерчивает область совместного существования газа и жидкости. В критич. точке К параметры Тк, рк и Vк имеют значения, характерные для данного в-ва. Однако если в В. у. ввести относит. величины Т/Тк, р/рк и V/VK, то можно получить т. н. приведённое В. у., к-рое явл. универсальным.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ
-
- уравнение состояния реального газа. Предложено И. Д. Ван-дер-Ваальсом (J. D. van der Waals) в 1873. Для газа, содержащего N молекул, В. у. имеет вид:
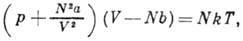
где V - объём, р - давление, T - абс. темп-pa газа, а и b - постоянные, учитывающие притяжение и отталкивание молекул. Член
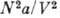 наз. внутр. давлением, постоянная b равна учетверённому объёму молекулы газа, если в качестве модели молекулы принять слабо притягивающиеся упругие сферы.
наз. внутр. давлением, постоянная b равна учетверённому объёму молекулы газа, если в качестве модели молекулы принять слабо притягивающиеся упругие сферы.
В. у. количественно определяет свойства реальных газов лишь в небольшом интервале Т и р - в области относительно высоких Т и низких р, т. к. а и b являются ф-циями темп-ры. Однако В. у. качественно правильно описывает поведение газа и жидкости и при высоких р, а также особенности фазового перехода между ними. При низких давлениях и относительно высоких темп-pax оно переходит в ур-ние состояния идеального газа ( Клапейрона уравнение), а при высоких давлениях и низких темп-pax учитывает малую сжимаемость жидкостей. В. у. описывает, кроме того, критическое и ме-тастабильное состояния системы жидкость - пар.
На рис. приведены в координатах р - V изотермы, рассчитанные по В. у., являющемуся кубическим относительно V. Возможны 3 случая решения В. у.: 1) все три корня действительные и равны между собой; этот случай соответствует критич. состоянию (изотерма Т кр; 2) все три корня действительные и различные - т. н. докритич. состояние (изотермы при T<T кр);3) два корня мнимые, не имеющие физ. смысла, один корень действительный; этот случай соответствует сверхкри-тич. состоянию (изотермы при T>T кр). Изотермы при Т/Т кр качественно описывают поведение реальных газов. При докритич. темп-pax Т< Т кр поведение газа описывается изотермой-изобарой насыщенного пара - прямой на диаграмме р - V, напр. прямой ас(р н.n.=const), а не S -образной кривой adec, соответствующей В. у.
Геом. место начальных и конечных точек "равновесия" а и с стабильной и метастабильной фаз (определяемое из условия равенства заштрихованных площадей) наз. бинодалью (кривая аКс). Кривая, соединяющая экстремальные точки типа d и е, наз. спинодалью (кривая dKe). Область, заключённая между бинодалью и спинодалью,- область неустойчивого, метастабиль-ного состояния системы. T. о., участки изотерм типа ad и ес относятся к метастабильному равновесию соответственно перегретой жидкости и системы жидкость+ газ, а также системы жидкость+газ и переохлаждённого газа. Участок dbe не имеет физ. смысла, т. к. на этом участке при росте р увеличивается и V, что невозможно.
При достаточно низких темп-pax участок adb опускается ниже изобары р=0. В этом случае имеющий физ. смысл участок ad попадёт в область отрицат. давлений, что соответствует неустойчивому состоянию растянутой жидкости.
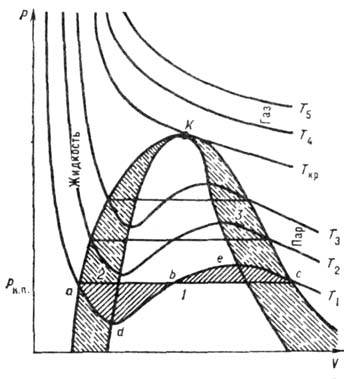
Диаграмма состояния вещества в координатах p-V:T1<T2< T3 <T кр < T4 < Т 5,-изотермы, рассчитанные по В. у.; К - критическая точка, линии аКс - бинодаль, dKe - спинодаль; 1 - область жидкость + газ; 2 и 3- области метастабильного состояния систем: перегретая жидкость и жидкость+ пар, переохлаждённый пар и жидкость+ пар. Заштрихованные площади adb и beс равны.
С помощью В. у. можно получить критич. параметры р кр, V кp и T кp. В точке К изотермы Ван-дер-Ваальса имеют как максимум, так и точку перегиба, т. е.
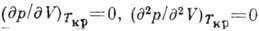 . Решение системы ур-ний Ван-дер-Ваальса и двух приведённых выше имеет вид:
. Решение системы ур-ний Ван-дер-Ваальса и двух приведённых выше имеет вид:
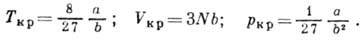
Несмотря на то, что постоянная b имеет подгоночный характер, размеры молекул, полученные с помощью выражения
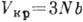 , хорошо согласуются с полученными др. методами.
, хорошо согласуются с полученными др. методами.
В. у., в к-рое введены относит. величины T/ Т кр, р/ р кр, T/T кр, наз. приведённым ур-нием состояния; оно имеет более широкое применение, чем В. у. Если в В. у. давление разложить по степеням плотности и сравнить с вириальним разложением, то постоянные а и b можно выразить через вириальные коэффициенты.
Лит. см. при ст. Газ. Ю. H. Любитов
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
