- МОЛЕКУЛА
- МОЛЕКУЛА
-
(новолат. molecule, уменьшит. от лат. moles — масса), наименьшая ч-ца в-ва, обладающая его осн. хим. св-вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч (нек-рые витамины, гормоны и белки). Атомы инертных газов часто называют одноатомными М., хотя, строго говоря, они не явл. М. Если М. состоит из тысяч и более повторяющихся единиц (одинаковых или близких по строению групп атомов), то её называют макромолекулой. В физике представление о М. возникло в 18 в. и получило широкое признание в 19 в. в связи с развитием термодинамики и теории газов и жидкостей. Во 2-й половине 19 в. с помощью разл. хим. методов были получены мн. важные сведения о строении М. Окончательно существование М. было подтверждено опытами франц. физика Ж. Б. Перрена по изучению броуновского движения (1906).Атомы в М. связаны между собой в определ. последовательности и определ. образом расположены в пр-ве. Наиб. общие хар-ки М.— мол. масса, состав и структурная ф-ла, указывающая последовательность хим. связей (напр., мол. масса М. воды 18, равная сумме масс входящих в неё атомов в атомных единицах массы, состав Н2О, структурная ф-ла Н—О—Н). Прочность межатомной связи характеризуется энергией хим. связи, к-рая составляет обычно неск. десятков кДж/моль. Атомы в М. непрерывно совершают колебат. движения; при определ. условиях, напр. в газовой фазе, М. могут совершать поступат. и вращат. движения. М., как и атомы, не имеют чётких границ. Размеры М. можно ориентировочно оценить, зная плотность в-ва, мол. м. и число Авогадро. Так, если допустить, что М. Н2O имеет сферич. форму, то диаметр её окажется равным =3•10-8 см (0,3 нм). Размеры М. растут с увеличением числа атомов в них и лежат в пределах 10-8—10-5 см. М. нельзя увидеть невооружённым глазом или с помощью оптич. микроскопа, однако существование М. доказывают мн. явления (броуновское движение, диффузия, дифракция рентг. лучей, эл-нов, нейтронов и т. д.).Устойчивость М. в среде зависит от её вз-ствия с др. атомами, а также от темп-ры, давления и др. внеш. факторов. В газообразном состоянии в-во, как правило, состоит из М. (кроме инертных газов, паров металлов). При достаточно высоких темп-pax М. всех газов распадаются на атомы. В конденсированных системах М. могут сохраняться. Вода во всех агрегатных состояниях состоит из М.; из М. построены большинство жидкостей и молекулярные кристаллы. В металлах и др. ат. кристаллах, а также их расплавах М., как правило, не существуют, т. к. в них каждый атом взаимодействует со всеми соседними приблизительно одинаково.Химическая связь.Возможность образования М. объясняется тем, что внутр. энергия М. как системы атомов ниже суммарной энергии этих атомов в изолиров. состоянии. Соответствующая разность энергии наз. энергией образования М. из атомов (или энергией атомизации), к-рая приближённо равна сумме энергий хим. связей.Для хим. связи существ. значение имеют лишь эл.-магн. вз-ствия эл-нов и ядер входящих в М. атомов. Наиболее часто встречаются М., в к-рых существуют ковалентные и ионные хим. связи.К о в а л е н т н а я с в я з ь возникает при обобществлении эл-нов (обычно электронных пар) двумя соседними атомами (т. е. за счёт обмена эл-нами). Хим. связь такого типа осуществляется в М. Н2, O2, СО и др. При сближении атомов ковалентная связь образуется только в том случае, когда спины их внеш. эл-нов антипараллельны. При этом происходит деформация электронных оболочек атомов, их перекрытие по линии, соединяющей ядра. При нек-ром межъядерном расстоянии силы притяжения уравновешиваются силами отталкивания и образуется устойчивая система, внутр. энергия к-рой минимальна.Ионная связь осуществляется электростатич. вз-ствием атомов при переходе эл-на одного из них к другому, т. е. при образовании положит. и отрицат. иона. Такая связь характерна для М. NaCl, KI и др. Ковалентные и ионные хим. связи явл. предельными; как правило, образуются смешанные хим. связи — частично ковалентные, частично ионные.Внутренняя энергия и уровни энергии молекул.Внутр. энергия М.— осн. хар-ка, определяющая её состояние и св-ва и зависящая от взаимного расположения составляющих её ч-ц и их движения. М. явл. квант. системой, и её внутр. энергия ? может принимать лишь определ. значения, т. е. квантуется. Внутр. энергия М. приближённо равна сумме энергий электронных движений ?э, колебаний ядер ?к и вращения М. как целого ?в, т. е. ?»?э+?к+?в, причём ?э->?к->?в. Каждая из указанных энергий квантуется в соответствии с законами квантовой механики, и ей соответствует набор дискретных уровней энергии (электронные, колебат. и вращат. уровни энергии).Состояние М. как квант. системы описывается Шредингера уравнением, к-рое учитывает электростатич. вз-ствия эл-нов с ядрами, эл-нов друг с другом, а также кинетич. энергию эл-нов и ядер. В адиабатическом приближении ур-ние Шредингера для М. распадается на два ур-ния — для эл-нов и для ядер. Решение (обычно приближённое) электронного ур-ния Шредингера — нахождение уровней энергии эл-нов — одна из осн. задач квантовой химии.М.— электрически нейтральные системы, однако электронная плотность в них распределена неравномерно. Число электронных уровней в М. значительно больше числа уровней энергии составляющих М. атомов, поскольку каждый атом М. находится в электрич. поле остальных атомов, в результате чего уровни расщепляются на многочисл. подуровни (Штарка эффект).Электронные уровни М. определяются совокупностью квантовых чисел, характеризующих состояния всех эл-нов М. Уровни, отвечающие значениям квант. числа L=0, 1, 2, ... полного орбит. момента М обозначаются соответственно S, П, D, ... (L представляет собой сумму орбитальных квант. чисел эл-нов; (см. АТОМ)). Квант. число S=0, 1, 2, ... определяет полный спиновый момент, внутр. квант. число W=Lr±S— полный момент М. Электронный уровень М. обозначают 2S+1LW, где слева вверху приводится мультиплетность уровня c=2S+1.Ур-ние Шредингера для ядер содержит информацию о колебаниях М. и вращениях её как целого. Решение этого ур-ния для двухатомной М. приводит к дискретным колебат. уровням, отстоящим один от другого на hv, если колебания ядер считать гармоническими (v — собств. частота осциллятора), и на hv-2(v+1)hva — при ангармонич. колебаниях (v — колебательное квант. число, а — постоянная ангармоничности). Колебания реальных двухатомных М. ангармоничны, и расстояние между колебат. уровнями энергии убывают с ростом v, а макс. колебат. энергия равна энергии диссоциации М.В многоатомной М. как связанной системе ч-ц колебания отд. атомов не независимы. Сложные колебания такой системы можно разделить на независимые гармонич. колебания, каждое из к-рых характеризуется определ. частотой; их называют н о р м а л ь н ы м и к о л е б а н и я м и.Колебания многоатомных М. в принципе могут быть изучены теоретически с помощью методов квант. химии, однако на практике обычно пользуются механич. моделью, оперирующей силовыми постоянными разл. структурных элементов М.Вращат. уровни двухатомной М. определяются выражением?в= h2J(J+1)/8p2I,где I — момент инерции М., относительно нек-рой оси вращения, J — вращат. квант. число.Аналогичные ф-лы, выведенные для многоатомных М., позволяют определять их геометрию по наблюдаемым чисто вращат. спектрам. Выражение для ?в резко усложняется, если, помимо вращения М. как целого, имеет место внутр. вращение, приводящее к ротамерам (см. ниже). Однако ф-лы для ?в дают возможность на основании вращат. спектров оценивать барьеры внутр. вращения и др. хар-ки М. Наряду с чисто электронными, колебат. и вращат. уровнями энергии в спектрах проявляются уровни, обусловленные электронно-колебат. и колебательно-вращат. вз-ствиями.Спектры излучения, поглощения, комбинац. рассеяния света возникают при переходах М. с одного уровня энергии на другой; при этом М. поглощает или излучает энергию, равную разности энергий этих уровней. Соответственно возникают электронные, колебат. и вращат. спектры М. (подробнее (см. МОЛЕКУЛЯРНЫЕ СПЕКТРЫ)).Структура молекулы. Геометрию М. можно описать декартовыми координатами атомов, однако чаще всего её характеризуют набором внутр. параметров — д л и н с в я з е й, в а л е н т н ы х и д в у г р а н н ы х у г л о в. Длиной связи наз. расстояние между ядрами атомов, соединённых между собой хим. связью. Обычно, чем больше длина связи, тем меньше её прочность.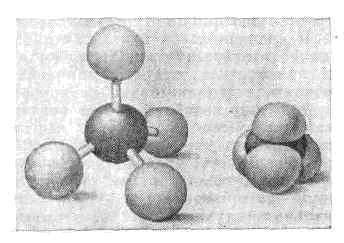 Трёхмерные модели молекул: слева — шаро-игловая модель: атомы изображены белыми шарами, валентные связи — выходящими из них стержнями; справа — объёмная модель Стюарта—Бриглеба: атомы представлены шарами, радиусы к-рых пропорц. ван-дер-ваальсовым радиусам.Валентным наз. угол между двумя хим. связями, выходящими из одного атома. Торсионные углы — это углы вращения вокруг связей. Так, в М. перекиси водорода, Н—О—О — Н, длины связей О—О и О—Н равны соотв. 0,147 и 0,095 нм, валентный угол Н—О—О равен 95° и торсионный угол (угол вращения вокруг связи О—О, или двугранный угол между плоскостями Н—О—О и О—О—Н) равен 112°.Каждое электронное состояние характеризуется равновесной геометрией (равновесной конфигурацией), отвечающей мин. энергии. В обычных условиях М. находится в основном электронном состоянии (на ниж. электронном уровне), и термин «равновесная конфигурация» часто относят только к этому состоянию. Так, приведённые выше внутр. геом, параметры М. Н—О — О — Н явл. равновесными, тогда как, напр., плоские формы этой М. (торсионный угол равен 0 или 180°) неравновесны. Зависимость внутр. энергии М. от геом. параметров для многоатомных М. может быть представлена многомерной поверхностью, наз. потенциальной поверхностью. Самый глубокий минимум потенц. энергии М. соответствует её равновесной конфигурации, метастабильным состояниям отвечают менее глубокие минимумы. Определение потенц. поверхности М. или хотя бы выявление нек-рых её особенностей явл. целью разл. эксперим. и теоретич. исследований.Расположение атомов в М. всегда обладает определённой симметрией (см. СИММЕТРИЯ МОЛЕКУЛЫ). Потенц. поверхность М. также обладает симметрией, что проявляется, напр., в инфракрасных спектрах М. или спектрах комбинационного рассеяния света.Нек-рые одинаковые по составу М. могут отличаться строением или расположением атомов. Такие формы существования в-ва наз. изомерами (см. ИЗОМЕРИЯ МОЛЕКУЛ). Структурные изомеры имеют разную последовательность хим. связей, и их М. изображаются разными структурными ф-лами (напр., нормальный бутан Н3С—СН2—СН2—СН3 и изобутан
Трёхмерные модели молекул: слева — шаро-игловая модель: атомы изображены белыми шарами, валентные связи — выходящими из них стержнями; справа — объёмная модель Стюарта—Бриглеба: атомы представлены шарами, радиусы к-рых пропорц. ван-дер-ваальсовым радиусам.Валентным наз. угол между двумя хим. связями, выходящими из одного атома. Торсионные углы — это углы вращения вокруг связей. Так, в М. перекиси водорода, Н—О—О — Н, длины связей О—О и О—Н равны соотв. 0,147 и 0,095 нм, валентный угол Н—О—О равен 95° и торсионный угол (угол вращения вокруг связи О—О, или двугранный угол между плоскостями Н—О—О и О—О—Н) равен 112°.Каждое электронное состояние характеризуется равновесной геометрией (равновесной конфигурацией), отвечающей мин. энергии. В обычных условиях М. находится в основном электронном состоянии (на ниж. электронном уровне), и термин «равновесная конфигурация» часто относят только к этому состоянию. Так, приведённые выше внутр. геом, параметры М. Н—О — О — Н явл. равновесными, тогда как, напр., плоские формы этой М. (торсионный угол равен 0 или 180°) неравновесны. Зависимость внутр. энергии М. от геом. параметров для многоатомных М. может быть представлена многомерной поверхностью, наз. потенциальной поверхностью. Самый глубокий минимум потенц. энергии М. соответствует её равновесной конфигурации, метастабильным состояниям отвечают менее глубокие минимумы. Определение потенц. поверхности М. или хотя бы выявление нек-рых её особенностей явл. целью разл. эксперим. и теоретич. исследований.Расположение атомов в М. всегда обладает определённой симметрией (см. СИММЕТРИЯ МОЛЕКУЛЫ). Потенц. поверхность М. также обладает симметрией, что проявляется, напр., в инфракрасных спектрах М. или спектрах комбинационного рассеяния света.Нек-рые одинаковые по составу М. могут отличаться строением или расположением атомов. Такие формы существования в-ва наз. изомерами (см. ИЗОМЕРИЯ МОЛЕКУЛ). Структурные изомеры имеют разную последовательность хим. связей, и их М. изображаются разными структурными ф-лами (напр., нормальный бутан Н3С—СН2—СН2—СН3 и изобутан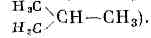 Структурные изомеры — это разные М., а соответствующие соединения обладают разными физ. и хим. св-вами. Так, темп-ра кипения нормального бутана равна +0,6 °С, а изобутана -11,7 °С.Поворотные изомеры (р о т а м е р ы, к о н ф о р м е р ы) возникают при вращении атомов или ат. групп вокруг хим. связей и отвечают разным минимумам потенц. поверхности М. Они представляют собой разл. состояния одной и той же М. Энергетич. барьеры, разделяющие поворотные изомеры, не превышают 100 кДж/моль, а время жизни этих изомеров обычно =10-10—10-13 с. При более высоких энергетич. барьерах (напр., при геом. изомерии М.) время жизни изомеров возрастает и появляется возможность их разделения.М. оптических изомеров энантиоморфны — зеркально симметричные одна по отношению к другой. Такие изомеры вращают плоскость поляризации света в противоположные стороны; остальные же физ. св-ва у них совершенно одинаковы (см. ОПТИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА).Свойства молекул. Исследование молекул.Хим. и большинство физ. св-в М. определяются их внеш. эл-нами. Так, внеш. эл-ны определяют оптич. спектры М. В спектрах М. проявляются мн. особенности их строения (симметрия, изомерия, природа хим. связи и т. д.). Индивидуальность спектров соединений, характеристичность частот колебаний определ. групп атомов в М. позволяют производить качеств. и количеств. спектральный анализ в-ва. Электронные уровни энергии изучают методами ультрафиолетовой спектроскопии, фотоэлектронной спектроскопии, рентгеноэлектронной спектроскопии. Колебат. уровни энергии проявляются в ИК спектрах и спектрах комбинац. рассеяния света. Частоты вращат. линий лежат в радиодиапазоне (см. МИКРОВОЛНОВАЯ СПЕКТРОСКОПИЯ), а также в дальней ИК области спектра.Во внеш. электрич. поле М. поляризуется — приобретает индуциров. дипольный момент (см. ПОЛЯРИЗУЕМОСТЬ АТОМОВ, ИОНОВ, МОЛЕКУЛ). Поляризация в-в из полярных М. (т. е. М., обладающих пост. дипольными моментами) во внеш. электрич. поле обусловлена как их ориентацией вдоль поля, так и возникновением индуциров. дипольных моментов за счёт электронной поляризуемости. Измерение диэлектрич. проницаемости и поляризации в-ва даёт возможность приблизительно оценивать поляризуемость и величину пост. дипольных моментов отд. М., что позволяет делать выводы о её строении — симметрии, распределении электронной плотности, присутствии тех или иных групп атомов и их расположении и т. д.Магн. св-ва М. дают важные сведения о строении электронной оболочки. Большинство М. диамагнитны, т. е. не имеют пост. магн. момента. Поведение таких М. в магн. поле определяется их отрицат. магнитной восприимчивостью. Парамагн. М., обладающие пост. магн. моментом, во внеш. магн. поле стремятся ориентироваться в направлении поля. Пост. магн. моментом (связанным со спином эл-нов, а также с их орбит. движением) могут обладать как электронная оболочка, так и ат. ядра. Парамагнитные (обладающие неспаренным эл-ном) М. исследуют с помощью электронного парамагнитного резонанса. В спектрах ядерного магнитного резонанса проявляются вз-ствия спиновых моментов ат. ядер, зависящие от электронной структуры М. и окружения каждого атома. На основании спектров ЯМР судят о направлении хим. связей, различных проявлениях изомерии М., взаимном расположении атомов в М., о динамике атомов в М. и т. д.Важный метод изучения М.— массспектроскопия. Масс-спектрометрич. измерения основаны на расщеплении М. на электрически заряж. фрагменты (радикалы) и определении масс этих фрагментов. Геометрию М. в кристаллах определяют с помощью дифракции рентг. лучей (см. РЕНТГЕНОВСКИЙ СТРУКТУРНЫЙ АНАЛИЗ) и нейтронов (см. НЕЙТРОНОГРАФИЯ). В газовой фазе и парах геометрию М. исследуют с помощью дифракции эл-нов (см. ЭЛЕКТРОНОГРАФИЯ) и микроволновых спектров. Эти исследования дают точность в определении координат атомов (ядер) порядка 0,001 нм; отсюда точность в определении длин связей =0,001 нм и в определении валентных и двугранных углов — 1—2°. Помимо дифракц. и спектроскопич. методов, существует ещё ряд методов исследования структурных, динамич. и термодинамич. хар-к М. Так, термодинамич. методы (в частности, калориметрия) позволяют определять разность энтальпий разл. изомеров, поглощение УЗ используется для установления равновесного содержания изомеров в жидкостях и р-рах и т. д.
Структурные изомеры — это разные М., а соответствующие соединения обладают разными физ. и хим. св-вами. Так, темп-ра кипения нормального бутана равна +0,6 °С, а изобутана -11,7 °С.Поворотные изомеры (р о т а м е р ы, к о н ф о р м е р ы) возникают при вращении атомов или ат. групп вокруг хим. связей и отвечают разным минимумам потенц. поверхности М. Они представляют собой разл. состояния одной и той же М. Энергетич. барьеры, разделяющие поворотные изомеры, не превышают 100 кДж/моль, а время жизни этих изомеров обычно =10-10—10-13 с. При более высоких энергетич. барьерах (напр., при геом. изомерии М.) время жизни изомеров возрастает и появляется возможность их разделения.М. оптических изомеров энантиоморфны — зеркально симметричные одна по отношению к другой. Такие изомеры вращают плоскость поляризации света в противоположные стороны; остальные же физ. св-ва у них совершенно одинаковы (см. ОПТИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА).Свойства молекул. Исследование молекул.Хим. и большинство физ. св-в М. определяются их внеш. эл-нами. Так, внеш. эл-ны определяют оптич. спектры М. В спектрах М. проявляются мн. особенности их строения (симметрия, изомерия, природа хим. связи и т. д.). Индивидуальность спектров соединений, характеристичность частот колебаний определ. групп атомов в М. позволяют производить качеств. и количеств. спектральный анализ в-ва. Электронные уровни энергии изучают методами ультрафиолетовой спектроскопии, фотоэлектронной спектроскопии, рентгеноэлектронной спектроскопии. Колебат. уровни энергии проявляются в ИК спектрах и спектрах комбинац. рассеяния света. Частоты вращат. линий лежат в радиодиапазоне (см. МИКРОВОЛНОВАЯ СПЕКТРОСКОПИЯ), а также в дальней ИК области спектра.Во внеш. электрич. поле М. поляризуется — приобретает индуциров. дипольный момент (см. ПОЛЯРИЗУЕМОСТЬ АТОМОВ, ИОНОВ, МОЛЕКУЛ). Поляризация в-в из полярных М. (т. е. М., обладающих пост. дипольными моментами) во внеш. электрич. поле обусловлена как их ориентацией вдоль поля, так и возникновением индуциров. дипольных моментов за счёт электронной поляризуемости. Измерение диэлектрич. проницаемости и поляризации в-ва даёт возможность приблизительно оценивать поляризуемость и величину пост. дипольных моментов отд. М., что позволяет делать выводы о её строении — симметрии, распределении электронной плотности, присутствии тех или иных групп атомов и их расположении и т. д.Магн. св-ва М. дают важные сведения о строении электронной оболочки. Большинство М. диамагнитны, т. е. не имеют пост. магн. момента. Поведение таких М. в магн. поле определяется их отрицат. магнитной восприимчивостью. Парамагн. М., обладающие пост. магн. моментом, во внеш. магн. поле стремятся ориентироваться в направлении поля. Пост. магн. моментом (связанным со спином эл-нов, а также с их орбит. движением) могут обладать как электронная оболочка, так и ат. ядра. Парамагнитные (обладающие неспаренным эл-ном) М. исследуют с помощью электронного парамагнитного резонанса. В спектрах ядерного магнитного резонанса проявляются вз-ствия спиновых моментов ат. ядер, зависящие от электронной структуры М. и окружения каждого атома. На основании спектров ЯМР судят о направлении хим. связей, различных проявлениях изомерии М., взаимном расположении атомов в М., о динамике атомов в М. и т. д.Важный метод изучения М.— массспектроскопия. Масс-спектрометрич. измерения основаны на расщеплении М. на электрически заряж. фрагменты (радикалы) и определении масс этих фрагментов. Геометрию М. в кристаллах определяют с помощью дифракции рентг. лучей (см. РЕНТГЕНОВСКИЙ СТРУКТУРНЫЙ АНАЛИЗ) и нейтронов (см. НЕЙТРОНОГРАФИЯ). В газовой фазе и парах геометрию М. исследуют с помощью дифракции эл-нов (см. ЭЛЕКТРОНОГРАФИЯ) и микроволновых спектров. Эти исследования дают точность в определении координат атомов (ядер) порядка 0,001 нм; отсюда точность в определении длин связей =0,001 нм и в определении валентных и двугранных углов — 1—2°. Помимо дифракц. и спектроскопич. методов, существует ещё ряд методов исследования структурных, динамич. и термодинамич. хар-к М. Так, термодинамич. методы (в частности, калориметрия) позволяют определять разность энтальпий разл. изомеров, поглощение УЗ используется для установления равновесного содержания изомеров в жидкостях и р-рах и т. д.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- МОЛЕКУЛА
-
(от новолат. molecula, уменьшит. от лат. moles - масса) - наименьшая устойчивая частица вещества, обладающая его осн. хим. и физ. свойствами. Состоит из атомных ядер и электронов, связанных между собой эл.-магн. силами; можно также считать M. системой атомов, связанных друг с другом разл. связями (см. Межатомное взаимодействие).
Представление о M. возникло в 18 в. и с развитием в 19 в. кинетич. теории газов и становлением термодинамики получило широкое распространение. Прямое эксперим. подтверждение существования M. провёл Ж . Перрон (J. Perrin) при изучении броуновского движения (1906).
Молекулярные вещества в газовой и жидкой фазах и в молекулярных кристаллах сохраняют индивидуальность. В расплавах и ионных кристаллах M., как правило, утрачивают индивидуальность, т. к. каждый атом в них связан с большим числом окружающих его атомов.
Хим. формула M.- брутто формула - указывает все входящие в неё атомы хим. символами элементов, а также число одинаковых атомов. Порядок расположения атомов в молекуле и характер связи между ними отражает структурная ф-ла M.
M. образуется из атомов при их сближении, если энергия связанного состояния меньше суммы энергий свободных атомов. Выделяемая при образовании M. энергия может передаваться др. частицам (переходить в тепло) или испускаться в виде кванта света ( хемилю-минесцснция), Соответственно, для отрыва от молекулы отд. атомов или атомных групп необходимо сообщить M. определ. энергию (энергию диссоциации). Число атомов в M. составляет от двух (H2, O2, HCl, СО) до сотен и тысяч (нек-рыe витамины, гормоны, белки).
Энергия отдельных хим. связей в M. составляет неск. эВ. Связь между атомами в M. осуществляется электронами незамкнутых оболочек (валентными электронами) так, чтобы система была электронейтральной, а электронная оболочка - замкнутой. Атомы с замкнутыми в основном состоянии оболочками могут образовывать хим. связи, если их перевести в возбуждённое состояние. Образующиеся при этом M. (напр., He*2) являются метастабильными и наз. эксимерными.
M. с открытыми (незамкнутыми) электронными оболочками (напр., ОН, CH2, NH2) наз. радикалами (свободными радикалами). M. и радикалы с нескомпенсированным электрич. зарядом, получающиеся при отрыве или присоединении электронов к нейтральной M.
(напр., H+2, H-2), наз. молекулярными (радикальными) нонами. Радикалы и ионы образуются как промежуточные продукты хим. реакций, при разл. воздействиях на M. и в обычных условиях неустойчивы, но в изолиров. состоянии (напр., в космич. пространстве) могут существовать долго.
Близкими к M. образованиями являются ван-дер-ваальсовские комплексы (HCl.Ar), молекулярные ассоциаты, ионные кластеры, ван-дер-ваальсовы молекулы и т. д., связанные между собой более слабыми, чем химические, связями - водородными или ван-дер-ваальсовыми. Комплексы могут состоять из двух, трёх и т. д. M. [(H2O)2, (NaCl)4], их называют димерами, три-мерами и т. д. Ионные кластеры образуются из иона H+3 и молекул H2 [напр.,
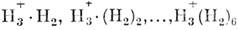 ].
].Такие системы неустойчивы и распадаются под внеш. воздействием.
В M. между валентными электронами в основном состоянии преобладает обменное взаимодействие, к-рое выстраивает спины электронов антипараллельно, поэтому осн. электронное состояние большинства M. синглетное, M. диамагнитна. Свободные радикалы обычно парамагнитны.
Структура M. В зависимости от числа валентных электронов, принимающих участие в хим. связи, последние наз. одинарными, двойными и тройными. Напр., атомы С в M. этана C2H6 связаны одинарной связью С - С, в M. этилена C2H4 - двойной связью C = C, а в M. ацетилена C2H2 - тройной связью C=C. Одинарная связь образуется двумя валентными электронами (s-электроны), двойная связь - четырьмя электронами (p-электроны), а тройная связь - шестью электронами (также p-электроны). Электроны внутр. замкнутых оболочек атомов практически не участвуют в хим. связи. Такая классификация хим. связей условна и не всегда приемлема. Она лучше всего подходит для классификации связей в разветвлённых (насыщенных) углеводородах и неприменима к циклич. углеводородам типа бензола (C6H6), т. к. в этом случае шесть одинаковых связей между атомами С, наз. также сопряжёнными связями, образуются за счёт 18 валентных электронов и рассмотренная классификация привела бы к полуторным связям.
В нек-рых случаях хим. связи образуются нечётным числом электронов. Так, в стабильном ионе H+2 связь образована одним электроном, в ионе H+3, имеющем структуру равностороннего треугольника, три связи H - H образованы всего двумя электронами и т. д. Кроме того, не все электроны внеш. электронной оболочки атомов принимают участие в хим. связи. Напр., в M. NH3 два из пяти внеш. электрона атома N не принимают участия в образовании связей и наз. неподелённой парой электронов. Бели при образовании связи между атомами А и Б электрон переносится от А к Б (или обратно), то связь между A и Б наз. ионной (напр., NaCl), а если валентные электроны распределены между А и Б равномерно, то связь А - Б наз. ковалент-ной (напр., H - H, С - С). Обычно ковалентные связи прочнее ионных. В сопряжённых системах типа бензола электроны, связывающие атомы С, равномерно распределены по всему кольцу.
Форма M. определяется пространств. расположением атомов в ней, к-рое в свою очередь определяется величинами длин связей и углов между связями (валентных углов). Между кратностью и длиной связи существует корреляция: связь между определ. атомами укорачивается с ростом её кратности. Напр., типичные величины длин связей С - С, <С = С и С = С соответственно равны 1,50, 1,35 и 1,20
 . Длина связи зависит от её хим. окружения в M. Напр., длина связи С - H в группе - CH3 составляет ок. 1,10
. Длина связи зависит от её хим. окружения в M. Напр., длина связи С - H в группе - CH3 составляет ок. 1,10  , а в группах =СН 2 и =CH 1,08 и 1,05
, а в группах =СН 2 и =CH 1,08 и 1,05 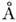 соответственно. Валентные углы между связями бывают самые разные, причём углы между одними и теми же связями в разл. M. могут быть различными, хотя определ. характеристичность существует и для углов. Напр., угол между связями С-H в группе -CH3, входящей в разл. M., часто близок к 109°. Если атом С образует четыре связи, то углы между этими связями близки к тетраэдрич. углу (109° 30'). Для качеств. описания формы M., содержащих атом С, важное значение имеет гибридизация атомных орбиталей С (см. Молекулярная орби-таль), т. е. образование из пары орбиталей внешних s -электронов и пары орбиталей р -электронов четырёх эквивалентных линейных комбинаций, наз. гибридными орбиталями.
соответственно. Валентные углы между связями бывают самые разные, причём углы между одними и теми же связями в разл. M. могут быть различными, хотя определ. характеристичность существует и для углов. Напр., угол между связями С-H в группе -CH3, входящей в разл. M., часто близок к 109°. Если атом С образует четыре связи, то углы между этими связями близки к тетраэдрич. углу (109° 30'). Для качеств. описания формы M., содержащих атом С, важное значение имеет гибридизация атомных орбиталей С (см. Молекулярная орби-таль), т. е. образование из пары орбиталей внешних s -электронов и пары орбиталей р -электронов четырёх эквивалентных линейных комбинаций, наз. гибридными орбиталями.Нек-рые представления о форме и геометрич. симметрии M., состоящей из данного набора атомов, можно получить на основе симметрии молекулы и концепции молекулярных орбиталей (МО). В зависимости от знака вклада, вносимого электроном данной МО в полную энергию M., МО наз. разрыхляющими или связывающими: связывающие участвуют в образовании прочных хим. связей, а разрыхляющие - не участвуют. Число связывающих и разрыхляющих МО зависит только от симметрии расположения атомов в M. Поэтому определение устойчивой формы M. сводится к нахождению такого расположения атомов, к-рому соответствует наиб. число связывающих МО. Напр., в случае CH4 для тетраэдрич. расположения четырёх атомов H вокруг С (симметрия Td )получается наиб. число связывающих МО - 8 (напр., для симметрии C3u. их 6). Разл. МО вносят разный вклад в энергию, и поэтому этот метод но всегда применим, но в большинство случаев он правильно предсказывает геом. симметрию M. (напр., он позволяет установить, что M. H2O - нелинейная, M. CO2 - линейная), особенно геом. симметрию M. в возбуждённых электронных состояниях. Структурные параметры для осн. электронного состояния мн. M. определены методами газовой электронографии, микроволновой спектроскопии и др. спектральными методами.
В зависимости от изотопич. состава атомов M. имеет изотопич. модификации. Напр., CH3D, CH2D2, CHD3, CD4 являются изотопич. модификациями метана (CH4). Структурные параметры изотопич. модификаций очень близки к структурным параметрам осн. M., а малые отличия (~ 0,01
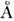 в длинах связей и ~1° в валентных углах) обычно обусловлены различием колебат. поправок к структурным параметрам. Кроме того, низкосимметричные изотопич. модификации неполярных M. могут быть слабо полярными с дипольным моментом ок. 0,01 дебая.
в длинах связей и ~1° в валентных углах) обычно обусловлены различием колебат. поправок к структурным параметрам. Кроме того, низкосимметричные изотопич. модификации неполярных M. могут быть слабо полярными с дипольным моментом ок. 0,01 дебая.В соответствии с симметрией равновесной конфигурации M., можно разделить на три класса: 1) M., не имеющие осей симметрии 3-го пли более высокого порядка; 2) M., имеющие одну ось симметрии 3-го или более высокого порядка; 3) M., имеющие неск. осей симметрии 3-го или более высокого порядка (см. Симметрия молекул).M. этих классов наз. асимметричными, симметричными и сферич. волчками соответственно. Линейная молекула является частным случаем симметричного волчка.
Классификация энергетических уровней M. Уровни энергии M. определяются из решения полного Шрёдин-гера уравнения методами квантовой химии. Численные решения ур-ния Шрёдингера выполнены только для очень простых M. (H+2 H2), для остальных M. проводится приближённое разделение ур-ния Шрёдингера на отдельные yp-ния для электронной и ядерной подсистем. Такое разделение проводят на основании Борна - Оппенгеймера теоремы. Решение ур-ния Шрёдингера для электронов даёт электронные уровни энергии M. в зависимости от координат ядер как от параметров (см. Потенциальная поверхность), а ур-ниe Шрёдингера для ядер - колебательно-вращательные уровни энергии в разл. электронных состояниях. Ур-ние Шрёдингера для ядер также разделяют на колебательное и вращательное. Электронная энергия M. в
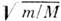 ( т - масса электрона, M - масса ядра) раз больше колебательной, к-рая в
( т - масса электрона, M - масса ядра) раз больше колебательной, к-рая в 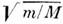 раз больше вращательной, что и позволяет произвести такое разделение. Взаимодействия между разл. видами движений (электронными, колебательными, вращательными) очень важны и составляют осн. предмет исследований в совр. молекулярной спектроскопии.
раз больше вращательной, что и позволяет произвести такое разделение. Взаимодействия между разл. видами движений (электронными, колебательными, вращательными) очень важны и составляют осн. предмет исследований в совр. молекулярной спектроскопии.Полные электронно-колебательно-вращательныо (рови-бронные) уровни энергии M. классифицируют по неприводимым представлениям (типам симметрии) группы симметрии молекулы. Разделение полного движения на отд. виды дает возможность ввести приближённые квантовые числа для классификации уровней M. В большинстве случаев эти числа связаны с собств. значениями квадратов и z -проекций соответствующих угл. моментов. В спектроскопии двухатомных M. используются угл. моменты и их квантовые числа, приведённые в табл.

Для линейных многоатомных M., симметричных и сферич. волчков кроме упомянутых угл. моментов используются также колебат. угл. моменты lt для каждого вырожденного колебания и полный колебат. угл. момент
 . Для симметричных волчков важное значение имеет квантовое число К проекции вращат. угл. момента на выделенную ось симметрии M.; К =0 в невырожденных колебат. состояниях и К = l ввырожденных колебат. состояниях линейных M. Для асимметричных волчков К теряет смысл, а для обозначения вращат. уровней используют символ JKaКc , где К а и К с являются проекц. квантовыми числами для предельных случаев вытянутого (a) и сплюснутого ( с )симметричного волчка. Для сферич. волчков К также но имеет смысла, и вместо него используют типы симметрии уровней с данными J и их кратность.
. Для симметричных волчков важное значение имеет квантовое число К проекции вращат. угл. момента на выделенную ось симметрии M.; К =0 в невырожденных колебат. состояниях и К = l ввырожденных колебат. состояниях линейных M. Для асимметричных волчков К теряет смысл, а для обозначения вращат. уровней используют символ JKaКc , где К а и К с являются проекц. квантовыми числами для предельных случаев вытянутого (a) и сплюснутого ( с )симметричного волчка. Для сферич. волчков К также но имеет смысла, и вместо него используют типы симметрии уровней с данными J и их кратность.Разл. электронные уровни с заданным L линейной M. обозначают S, П, D, F, ... в соответствии со значениями L = 0,1,2,3,... Между типами симметрии и значениями L имеется взаимно однозначное соответствие, поэтому неприводимые представления точечных групп
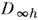 и
и  также обозначаются S , П, D, F. Мультиплет-ность уровня, определяемая значениями 2S + 1, записывается слева сверху L. Напр., 3S обозначает уровень с L = 0 и S = 1, а 2 П обозначает уровень с L = 1 и S =1/2. К этому символу добавляется значение J, N или F для каждого вращат. подуровня, а если необходимо, то ещё и номер колебат. уровня u. Для нелинейных M. L не имеет смысла, вместо L используется тип симметрии, а остальные обозначения сохраняются.
также обозначаются S , П, D, F. Мультиплет-ность уровня, определяемая значениями 2S + 1, записывается слева сверху L. Напр., 3S обозначает уровень с L = 0 и S = 1, а 2 П обозначает уровень с L = 1 и S =1/2. К этому символу добавляется значение J, N или F для каждого вращат. подуровня, а если необходимо, то ещё и номер колебат. уровня u. Для нелинейных M. L не имеет смысла, вместо L используется тип симметрии, а остальные обозначения сохраняются.В простейшем приближении каждому нормальному колебанию M. vk сопоставляется гармонический осциллятор с энергией

где wk - волновое число, uk - колебат. квантовое число. Состояние M., в к-ром возбуждено неск. колебаний, обозначают набором чисел uk. Напр., состояние (1, 2, 1) M. H2O характеризуется числами u1.= 1, u2 = 2 и u3 =1 (иногда такое состояние обозначают v1 + 2v2 + v3). Если возбуждены вырожденные колебания, то квантовые числа ut снабжаются также верхним индексом ls, указывающим квантовое число колебат. углового момента, равное but, b(ut -2), ...: напр., состоянию (2,3b1, 1) отвечают квантовые числа u1 =2, u2 = 3, l2= b1, u3.= 1.
Вращательные уровни энергии M. в 1S -состоянии. Вращат. уровни M. качественно описываются в рамках модели жёсткого волчка. Вращат. энергия жёсткой (т. е. колебания её атомных ядер незначительны) двухатомной M. в 1S-состоянии
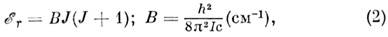
где В - вращат. постоянная, I - момент инерции. Ф-ла (2) справедлива также для жёсткой линейной M. и для жёсткого сферич. волчка в 1S-состоянии, причём каждый J - уровень сферич. волчка (2J +1)-кратно вырожден по проекции J на одну из осей M. (для линейной M. эта проекция равна нулю). Для жёсткого симметричного волчка два из трёх гл. моментов инерции равны между собой и энергия
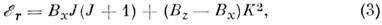
где z - выделенная ось симметрии волчка, а ось x перпендикулярна z. Оси инерции M. принято обозначать также буквами а, b, с, причём Ia<= Ib <= I с, a вращат. постоянные буквами A >= В >= С. В зависимости от соответствия между осями х, у, z и а, b, с симметричные волчки разделяются на два класса - вытянутые, для к-рых энергия

и сплюснутые, для к-рых
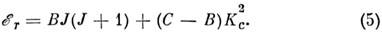
В качестве оси квантования вращат. угл. момента в (4) выбрана ось a (Ib= I с), а в (5) - ось с (Ia = Ib).
При промежуточных значениях В уровни с разд. значениями пары чисел К а, К с при заданном J не пересекаются, поэтому символ JKaKc является однозначной характеристикой вращат. уровней асимметричного волчка, когда I а
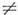 Ib
Ib 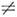 Ic. Числа J, К а и К с тесно связаны с числом и ориентацией узлов волновой ф-ции асимметричного волчка. Энергия увеличивается с ростом К а и уменьшается с ростом Kc, т. е. энергия растёт в соответствии с последовательностью квантовых чисел:
Ic. Числа J, К а и К с тесно связаны с числом и ориентацией узлов волновой ф-ции асимметричного волчка. Энергия увеличивается с ростом К а и уменьшается с ростом Kc, т. е. энергия растёт в соответствии с последовательностью квантовых чисел: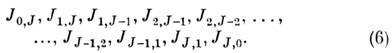
Сумма К а+ К с равна J (при чётном J )или J + 1 (при нечётном J). Асимметрия волчка характеризуется параметром:
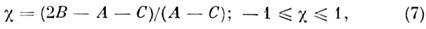
к-рый равен -1 для вытянутого и +1 для сплюснутого симметричных волчков. Поэтому вместо JKaKc пишут также JK-1K+1. Энергия асимметричного волчка определяется только численно как собств. значения матрицы энергии, записанной в базисе волновых ф-ций симметричного волчка. Отличные от нуля элементы этой матрицы равны:
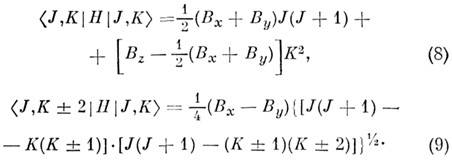
Вырождение уровней по знаку К а и К с, присущее симметричному волчку, для асимметричного волчка снимается недиагональными элементами в (9). Получающееся при этом расщепление наз. K -удвоением: величина K -удвоения максимальна при К =1 и падает с ростом К.
Модель жёсткого волчка является грубым приближением к реальной M. Реально M. при вращении искажается, и такое центробежное искажение даёт существенный вклад в её энергию. В случае двухатомной M. основная (квартичная) центробежная поправка к (3) равна

где DJ =4 В3/w2, и если В =1 см -1 и w = 1000 см -1, то DJ =4·10-6 см -1 = 120 кГц, поправка к энергии при J =10 равна 1,2 ГГц. Для сферич. волчка (напр., M. CH4) квартичиая центробежная поправка состоит из двух частей:
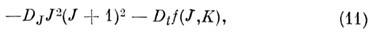
из к-рых первая - изотропная и не зависит от проекции J, а вторая - анизотропная и расщепляет уровень с заданным J на подуровни разл. типов симметрии. Напр., для CH4 Dt = 132 кГц и уровень с J= 2 расщепляется на компоненты с интервалом между ними 60 Dt . Ф-ция f(J, К )определяется численно. Она ~J4, и расщепление быстро растёт с ростом J: при заданном J её мин. значение равно -4J2(J + 1)2, а макс. значение равно +8J2(J + 1)2. Для симметричных волчков центробежная поправка также состоит из двух частой, из к-рых первая
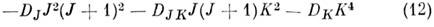
сдвигает уровни, а вторая, зависящая от симметрии M., может приводить к снятию вырождения уровней по знаку К. Для асимметричных волчков центробежная поправка к энергии определяется только численно. Константы квартичного центробежного искажения зависят от квадратичных членов разложения потенциальной поверхности и используются для определения гармонич. силовых постоянных M. Обычно из вращат. спектров M. определяются также константы центробежных поправок более высокого порядка (секстичные, октичные и др.), к-рые содержат информацию о константах энгармонизма M.
Колебательные уровни энергии M. В гармонич. приближении энергия колебат. уровней M. определяется суммой выражений типа (1) по всем нормальным колебаниям, к-рые возбуждены в данном состоянии:
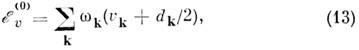
где dk - степень вырождения k- гоколебания. Для M. типа асимметричного волчка все гармонич. колебат. состояния невырождсны и энгармонизм только сдвигает их, как правило, вниз. Кубич. и квартичные члены разложения потенц. поверхности во втором приближении теории возмущении дают след. вклад в энергию:

где xjk. - постоянные ангармоничности, к-рые составляют обычно 1
 10 см -1, но для лёгких атомов возрастают до 100 см -1. В гармонич. приближении (13) энергия колебат. уровней не зависит от колебат. угловых моментов lt. Поэтому состояния M. типа симметричного и сферич. волчков, в к-рых возбуждены вырожденные колебания, могут быть вырожденными. Это вырождение частично снимается энгармонизмом, и получающееся расщепление называется ангармонич. расщеплением. Для M. такого типа энергия колебат. уровней рассчитывается по более общей, чем (14), ф-ле:
10 см -1, но для лёгких атомов возрастают до 100 см -1. В гармонич. приближении (13) энергия колебат. уровней не зависит от колебат. угловых моментов lt. Поэтому состояния M. типа симметричного и сферич. волчков, в к-рых возбуждены вырожденные колебания, могут быть вырожденными. Это вырождение частично снимается энгармонизмом, и получающееся расщепление называется ангармонич. расщеплением. Для M. такого типа энергия колебат. уровней рассчитывается по более общей, чем (14), ф-ле: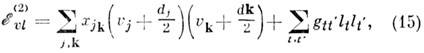
в к-рой ангармонич. расщепление уровней представлено вторым членом. Напр., в M. с симметрией C3u. (напр., NH3) уровень с ut= 2, lt =0, b2 (все остальные uk = 0) расщепляется на подуровни с lt =0 и lt=b2 с интервалом между ними 4gtt', а уровень с ut =1, lt = b1 и ut'.=1, lt' = b1 расщепляется на подуровни с lt + lt' =0 и lt= b2 с интервалом между ними 2gtt'. Ангармонич. расщепления вырожденных колебат. уровней M. типа симметричного и сферич. волчков (BF3, SF6 и т. д.) играют важную роль в многофотонном поглощении ИК-излучения.
Ф-лы (14) и (15) справедливы при отсутствии т. н. ангармонич. резонансов. Если осн. гармонич. частота wk равна или близка к составной гармонич. частоте wi + wj и коэф. ангармоничности Kijk
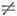 0, то ангар-монизм приводит к сильному перемешиванию состояний и аномальному сдвигу уровней, наз. случайными ангармонич. резонансами (или резонансами Ферми). Впервые такой эффект наблюдэлся в спектре комбинац. рассеяния света M. CO3 и был интерпретирован Э. Ферми (E. Fermi) в 1931: сильное перемешивание состояний с u1 =1 и u2l2.=20 приводит к появлению в спектре комбинац. рассеяния двух полос v1 и 2v2 вблизи 1200 см -1 с близкой интенсивностью (в отсутствие резонанса полоса 2v2 должна была быть намного слабее).
0, то ангар-монизм приводит к сильному перемешиванию состояний и аномальному сдвигу уровней, наз. случайными ангармонич. резонансами (или резонансами Ферми). Впервые такой эффект наблюдэлся в спектре комбинац. рассеяния света M. CO3 и был интерпретирован Э. Ферми (E. Fermi) в 1931: сильное перемешивание состояний с u1 =1 и u2l2.=20 приводит к появлению в спектре комбинац. рассеяния двух полос v1 и 2v2 вблизи 1200 см -1 с близкой интенсивностью (в отсутствие резонанса полоса 2v2 должна была быть намного слабее).Ангармонич. резонансы наблюдаются и при wi b wj
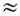 wk b wl, wi
wk b wl, wi 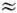 wj b wk b wl и т. д., если отличны от нуля соответствующие коэффициенты ангармоничности. Ангармонические резонансы могут иметь место только между колебат. уровнями одинакового типа симметрии.
wj b wk b wl и т. д., если отличны от нуля соответствующие коэффициенты ангармоничности. Ангармонические резонансы могут иметь место только между колебат. уровнями одинакового типа симметрии.Вращательные уровни вырожденных колебательных состояний. Вращат. уровни возбуждённых невырожденных колебат. состояний отличаются от вращат. уровней осн. состояния только тем, что величины вращат. и центробежных постоянных немного (на 0,1
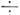 1%) отличаются от их величин для осн. состояния, хотя при наличии случайных резонансов вращат. структура возбуждённого состояния может быть сильно деформированной. Качеств. отличие вращат. структуры вырожденных колебат. состояний от вращат. структуры невырожденных состояний определяется прежде всего наличием в вырожденных состояниях колебат. угловых моментов lt. Для симметричного волчка взаимодействие lt с вращат. угловым моментом J (наз. также ко-риолисовым взаимодействием) вносит вклад в энергию, к-рый в первом приближении равен:
1%) отличаются от их величин для осн. состояния, хотя при наличии случайных резонансов вращат. структура возбуждённого состояния может быть сильно деформированной. Качеств. отличие вращат. структуры вырожденных колебат. состояний от вращат. структуры невырожденных состояний определяется прежде всего наличием в вырожденных состояниях колебат. угловых моментов lt. Для симметричного волчка взаимодействие lt с вращат. угловым моментом J (наз. также ко-риолисовым взаимодействием) вносит вклад в энергию, к-рый в первом приближении равен: где Szt - постоянные кориолисова взаимодействия, зависящие от формы нормальных колебаний и структурных парэметров M. Кориолисово взаимодействие даёт вклад в ангармонич. расщепление уровней с различными |lt|. Кроме того, оно расщепляет уровень с bК,b l от уровня с bК, bl, но уровни с + К, +l и - К,-l, а также уровни с +К, -l и - К,+l остаются вырожденными: это вырождение снимается эффектами колеба-тельно-вращат. взаимодействия более высокого порядка. В частном случае M. симметрии C3u. при К= lt= b1 (или Klt= +1) происходит расщепление на подуровни величиной qtJ(J +1), получившей назв. l -удвоения; константа l -удвоения qt зависит от кубич. коэф. ангармоничности. Такое удвоение имеет место и для линейных молекул, для к-рых, однако, qt зависит только от гармонич. части потенц. поверхности.
где Szt - постоянные кориолисова взаимодействия, зависящие от формы нормальных колебаний и структурных парэметров M. Кориолисово взаимодействие даёт вклад в ангармонич. расщепление уровней с различными |lt|. Кроме того, оно расщепляет уровень с bК,b l от уровня с bК, bl, но уровни с + К, +l и - К,-l, а также уровни с +К, -l и - К,+l остаются вырожденными: это вырождение снимается эффектами колеба-тельно-вращат. взаимодействия более высокого порядка. В частном случае M. симметрии C3u. при К= lt= b1 (или Klt= +1) происходит расщепление на подуровни величиной qtJ(J +1), получившей назв. l -удвоения; константа l -удвоения qt зависит от кубич. коэф. ангармоничности. Такое удвоение имеет место и для линейных молекул, для к-рых, однако, qt зависит только от гармонич. части потенц. поверхности.Электронные уровни энергии M. Численные значения энергий электронных уровней M. определяются методами квантовой химии, число же уровней разл. типов симметрии и их относит. расположение могут быть найдены на основе модельных представлений и соображе-ний симметрии. Если рассматривать M. как объединённый атом (о. а.) или более простую объединённую M. (о. м.) с тем же числом электронов, то возможные электронные уровни рэзл. типов симметрии точечной группы M. можно определить, рассматривая расщепление электронных уровней о. а. или о. м. в электрич. поле искомой M. или просто корреляцию между уровнями о. а. и M. или же о. м. и M., к-рая легко определяется из характеров точечных групп. Напр., о. а. для CH4 является этом Ne, а первые три уровня 1Sg, 3Pu, 1Pu коррелируют с уровнями типa 1A1, 3F2, 1F2M. CH4 соответственно, т. е. основным уровнем CH4 является уровень 1A1, первое возбуждённое состояние 3Pu этома Ne приводит к 3F2 -состоянию CH4 и т. <д. Ясно, что коррелируют уровни о. а. и M. с одинаковой мультиплет-ностью. Это справедливо, пока спин-орбитальное расщепление мало, а если же оно велико, то необходимо проводить корреляцию между полными волновыми ф-циями, учитыва-ющими спин.
Электронные уровни M. можно получить также из уровней разъединённых атомов (р. а.) или групп зто-мов по векторной модели. При этом квантовое число L получается алгебраич. сложением проекций MLi орбитальных моментов всех атомов,

а полный электронный спин M. получается как векторная сумма спинов атомов

Напр., если M. HCN образована из атомов И, С, N в их основных состояниях 2Sg,3Pg, 4Su соответственно, то L = 1 или 0 и S =3, 2.2, 1, 1, 0 и для HCN получаются след. уровни: 1S, 1P, по два уровня типа 3S, 3P, 5S, 5P, по одному уровню 7S и 7 П. Уровни HCN можно получить также из уровней H и CN.
Модели о. а. и р. а. позволяют определить кол-во электронных уровней разл. типов симметрии, но не дают надёжных сведений относительно их энергии. Более полную информацию о расположении уровней и их устойчивости дают молекулярные орбитали.
Электронные уровни энергии расщепляются за счёт спин-орбитального взаимодействия на т. н. мультиплет-иые уровни (см. Мультиплетность). В случае нормальной связи это расщепление равно:

константа А спин-орбитального взаимодействия быстро растёт с ростом зарядов ядер атомов, составляющих M. Квантовые числа L и S теряют смысл хороших квантовых чисел, а расщеплённые подуровни теперь характеризуются значениями квантового числа W = = L + S проекции полного электронного угл. момента на ось M. Напр., уровень 3 П линейной M. за счёт спин-орбитального взаимодействия расщепляется на подуровни S + , S-, П, D, соответствующие значениям W = 0,0, l, 2. Константа А составляет от неск. см -1 для лёгких M. до неск. сотен см "1 для тяжёлых M.
Колебательная структура вырожденных электронных состояний M. Колебат. структура синглетных электронных состояний M. описывается ф-лами (13) - (15), в к-рых, однако, следует учесть зависимость частот колебаний и постоянных ангармоничности от электронного состояния. Они также описывают уровни невырожденных колебаний в вырожденных электронных состояниях или же уровни вырожденных колебаний в невырожденных электронных состояниях. Качественно новые эффекты возникают в вырожденных электронных состояниях при возбуждении вырожденных колебаний, в основном за счёт взаимодействия колебат. угловых моментов вырожденных колебаний с электронным орбитальным угл. моментом.
Для симметричного волчка или линейной молекулы электронно-колебательные (вибронные) уровни энергии можно классифицировать по значениям квантового числа К =L + l проекции вибронного угл. момента на ось симметрии M. Электронно-колебат. взаимодействие снимает вырождение по L и l, и вибронные уровни энергии расщепляются. В M. типа симметричного и сферич. волчков линейные члены разложения электронного гамильтониана по координатам вырожденных колебаний не равны нулю, расщепление виб-ронных уровней в этом случае наз. линейным эффектом Яна - Теллера (см. Вибронное взаимодействие). Энергия расщеплённых подуровней даётся ф-лой:
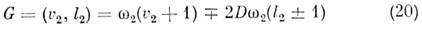
при малых величинах параметра Яна - Теллера D. Для линейных M. линейные члены разложения электронного гамильтониана равны нулю и расщепление описывают квадратичные члены разложения (эффект Рен-пера). В реальных M. эффекты Яна - Теллера и Рен-пера следует учитывать совместно с ангармонизмом и спин-орбитальным взаимодействием.
Вращательная структура вырожденных вибронных состояний. Определяющую роль в формировании вра-щат. структуры вырожденных электронных и вибронных состояний играют взаимодействия вращат. углового момента с электронным спином и орбитальным (или вибронным) угл. моментом. В общем случае многоатомной M. учёт всех этих взаимодействий довольно сложен. Для двухатомных M. различают неск. предельных случаев связи угл. моментов, получивших назв. случаев Хунда. В случае а предполагается наличие сильного спин-орбитального взаимодействия, что справедливо для достаточно тяжёлых M. В этом случае сначала учитывают связь L и S, а затем - связь суммарного момента j = L + S с R. В случаях Хунда b спин-орбитальное взаимодействие предполагается очень слабым (справедливо для лёгких M. и для всех S-состояний): сначала учитывают связь R с L, а затем N=R+L с S и получают J. Существуют и др. случаи Хунда. Ниже приведены вращат. энергии для M. типа жёсткого волчка для случаев а, b, с и d.

Взаимодействие вращат. углового момента с электронными моментами приводит к снятию вырождения, указанного в последнем столбце этой табл. В 1P-состояниях взаимодействие типа L2J2 приводит к эффекту L-удвоения с величиной Dv = qeJ(J + 1), где qe
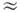 2 В2 е /ve,a ve - разность энергии и ближайшего 1S-состояния.
2 В2 е /ve,a ve - разность энергии и ближайшего 1S-состояния.Ядерная сверхтонкая структура энергии уровней M.
Каждый уровень энергии M. может иметь ядерную сверхтонкую структуру (CTC), обусловленную наличием у ядер электрич. и магн. моментов. В электронном 1S-состоянии ядерная CTC уровней формируется в результате: 1) электростатич. взаимодействия электрич. квадрупольного момента ядра с электрич. полем M. (квадрупольное взаимодействие или квадрупольная связь); 2) взаимодействия магн. дипольного момента ядра с магн. полем, возникающим при вращении M. (ядерное спин-вращательное взаимодействие); 3) взаимодействия магн. моментов разл. ядер между собой (ядерные спин-спиновые взаимодействия).
Обычно квадрупольное взаимодействие даёт осн. вклад в CTC, но оно имеет место только для ядер со спином l > 1/2 (напр., D, 14N, Cl, Br, I). В простейшем случае одиночного квадрупольного ядра в двухатомной M. энергия квадрупольного взаимодействия описывается ф-лой
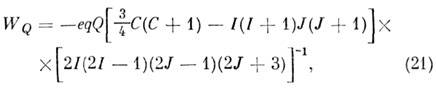
где е - заряд электрона, q - градиент элeктрич. ноля, Q - квадрупольный момент ядра, J - вращат. квантовое число, I - спин ядра,
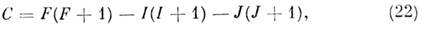
a F - квантовое число полного угл. момента F= =J + I, получающее значения F = J + 1, J+ I - 1, J + I - 2, .., J - I. Число J теряет смысл хорошего квантового числа, и уровни CTC классифицируются по значениям F. Напр., вращат. уровень с J = 1 в случае ядра со спином I = 5/2 (ядра Al, I и др.) расщепляется на три подуровня с F= 5/2, 7/2 и 3/2 с энергией WQ =+4 еqQ/25, - egQ/20и - 7eqQ/50. Константа квадрупольпой связи eqQ зависит и от типа ядра и от молекулярного окружения и изменяется в широком интервале.
Квадрупольная CTC обычно наблюдается в спектрах высокого разрешения. Спин-вращательные и спин-спиновые взаимодействия дают небольшой вклад в CTC и имеют место для всех ядер со спином I >= 1/2 (I = 1/2 для H, F и др.). Расщепления вращат. уровней за счёт этих взаимодействий составляют обычно не более 100 кГц и наблюдаются только на уникальных установках (пучковые мазеры, электрич. резонанс в пучке и Др.). Экспeрим. данные по константам квадруполь-ной связи и спин-вращательного взаимодействия дают ценную информацию об электронном строении M., а константы спин-спиновых взаимодействий зависят только от гсом. параметров M.
В вырожденных электронных состояниях важное значение имеют взаимодействия электронного спина с ядерными спинами, энергия к-рых в gem Б/gI m Я раз больше энергии чисто ядерных спин-спиновых взаимодействий, где gc и gI - электронный и ядерный g -факторы, m Б - магнетон Бора, m Я - ядерный магнетон. Электрон-ядерные спин-спиновые взаимодействия бывают двух видов: 1) классич. диполь-дипольное взаимодействие (анизотропное), энергия к-рого в общем случае произвольной M. определяется тензором второго ранга с 9 компонентами; 2)не имеющее классич. аналога изотропное контактное взаимодействие Ферми aSI, обусловленное наличием электронной спиновой плотности в место расположения ядра. В отличие от анизотропного спин-спинового взаимодействия контактное взаимодействие имеет место только в состояниях с L = 0, аналогичных s -состояниям атомов, т. к. только атомные s -орбитали создают спиновую плотность в месте расположения ядра. Константы обоих видов взаимодействий зависят от электронной плотности M. p дают ценную информацию об электронных волновых ф-циях M.
Все физ. и хим. свойства M. так или иначе связаны с системой уровней энергии M. и с переходами между ними под действием внеш. возмущений.
Электрические свойства M. Молекула как система положит. и отрицат. зарядов характеризуется опре-дел. расположением зарядов, т. с. обладает электрич. дипольным, квадрупольным и т. д. моментами. Определяет электрич. свойства M. её дипольный момент m:

где ei, ri - заряд и радиус-вектор i -й частицы, входящей в M. Вектор m можно разложить на составляющие ma, mb и m с по направлениям гл. осей инерции a, b и с. Асимметрия распределения заряда r характеризуется квадрупольным моментом, к-рый для M. определяется так же, как и для ядра:
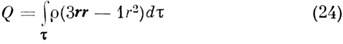
или
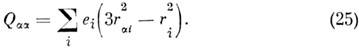
Дипольный момент M. определяет интенсивности линий в спектрах поглощения и испускания, различные электрич. явления в газах (электрич. потери, отклонения пучков M. в неоднородных электрич. полях и т. д.). Электрич. дипольный момент M. d зависит от нормальных колебат. координат qk, и при малых смещениях ядер из положения равновесия его можно разложить в ряд Тейлора по степеням qk. Первый не зависящий от qk член m е этого ряда наз. постоянным дипольным моментом M. Не все M. имеют пост. дипольный момент. Он отличен от нуля, если по крайней мере одна из компонент электрич. дипольного момента принадлежит к полносимметричному типу симметрии группы симметрии M. Если m
 0, то M. наз. полярной, a M. с m = 0 наз. неполярными. К полярным, напр., относятся H2O, NH3, к неполярным - CH4, BF3, CO2. В M. NH3 дипольный момент me направлен по оси симметрии C3, вH2O m еа - по оси C2,a meb - перпендикулярно оси C2.
0, то M. наз. полярной, a M. с m = 0 наз. неполярными. К полярным, напр., относятся H2O, NH3, к неполярным - CH4, BF3, CO2. В M. NH3 дипольный момент me направлен по оси симметрии C3, вH2O m еа - по оси C2,a meb - перпендикулярно оси C2.Наиб. прецизионный метод определения me состоит в измерении расщепления уровней энергии и соответствующих спектральных линий при наложении на M. внеш. электрич. поля (Штарка эффект). В общем случае вращат. уровень с заданными J, К расщепляется в электрич. поле на (2J + 1) компонентов, т. к. в электрич. поле энергия уровня зависит ещё и от магн. квантового числа т, т. е. квантового числа проекции угл. момента J на направление поля: т= -J, -J +1, .., + J. Обычно напряженность внеш. электрич. поля E выбирают так, чтобы энергия взаимодействия M. с полем (-mE )была значительно меньше энергии вращат. перехода. Тогда величина штарковского расщепления уровня энергии зависит от E или линейно (эффект Штарка 1-го порядка), или квадратично (эффект Штарка 2-го порядка); в общем случае она выражается как аЕ + bЕ2+... . Если поле направлено по оси z, фиксированной в пространстве, то энергия взаимодействия M. с полем будет равна -mzEz, где mz - проекция m на ось z.
Электрич. дипольный момент обычно измеряют в единицах Дебая: 1Д = b10-18 СГСЕ. Для полярных M. он составляет от долей до неск. Д (напр., для SO2 me = meb = 1,58Д, для OCS me= 0,7124Д, для KCl me = 10,27 Д, для NH3 me= 1,49 Д). Константа Штарка mE= 0,50344 (МГц/Д). (В/см). Поэтому при точности измерений частот ок. 10 кГц штарковское расщепление в полях 102-103 В/см достаточно велико и поддаётся весьма точному измерению. Обычно дипольный момент M. измеряется с точностью до 0,01 Д, но в спец. экспериментах достигнута точность вплоть до 10-7 Д.
Магнитные свойства M. В состоянии с орбитальным моментом L электрона M. имеет орбитальный магн. момент

а в состоянии со спином S - спиновой магн. момент

где m Б - магнетон Бора, gs - спиновый g -фактор свободного электрона (см. Ланде множитель); знак минус указывает на то, что магн. и механич. моменты направлены антипараллельно. В 1S-состоянии (L= S=0) электронный магн. момент отсутствует, но M. может иметь небольшой магн. момент, к-рый возникает из-за вращения M. При вращении M. происходит слабое перемешивание электронной волновой ф-ции основного состояния с волновыми ф-циями возбуждённых "парамагнитных" состояний. Кроме того, вращение ядер само по себе создаёт магн. момент. При этом возникает т. н. вращательный магн. момент с компонентами по гл. осям инерции в виде:
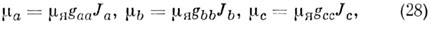
где m Я - ядерный магнетон и gaa, gbb, gcc - компоненты тензора вращат. g -фактора, определяемые для основного состояния по ф-ле:
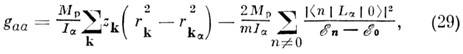
где Mp - масса протона, Ia - гл. моменты инерции, т - масса электрона, zk - заряд k -го ядра, rk - его радиус-вектор, rka - проекция rk на ось a, a суммирование по n проводится по всем возбуждённым электронным состояниям, связанным с основным состоянием матричными элементами орбитального момента: первый член даёт вклад ядер, второй - вклад электронов. Очевидно, что вращат. магн. момент намного (в 103-104 раз) меньше орбитального и спинового магн. моментов. Энергия взаимодействия магн. момента m. с внеш. магн. полем H, направленным по оси z лабораторной системы координат, даётся ф-лой:

где
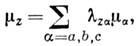
lza - направляющая косинусов компонентов ma в гл. осях инерции относительно оси z. Можно показать, что оператор H имеет диагональные матричные элементы в состоянии |J, т, Г > типа симметрии Г, если тип симметрии JM содержится в симметричном произведении [Г 2], т. е. если
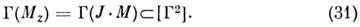
T. к. Mz всегда относится к полносимметричному типу симметрии и [Г 2] всегда содержит полносимметричный тип, условие (30) фактически не ограничивает класс состояний, в к-рых H имеет диагональные элементы. T. о., расщепление уровней энергии во внеш. магн. поле (Зеемана эффект )происходит для всех M. уже в первом приближении, т. е. наличие линейного по нолю эффекта Зеемана ничем не ограничено. Величина линейного зеемановского расщепления для жёсткого асимметричного волчка даётся ф-лой:

где

ср. значение <J2a> определяют численно. Для симметричного волчка
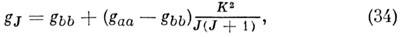
а для линейной M. gJ= g, т. е. не зависит от J. Обычно расщепления уровней энергии за счёт вращат. эффекта Зеемана малы и для их точного измерения используют магн. поля ~ (20-50).103 Гс. Следует отметить, что в таких сильных полях, вследствие магн. восприимчивости c, в M. возникает ещё и наведённый магн. момент, к-рый также вносит вклад в зеемановское расщепление.
По величине зеемановского расщепления уровней энергии определяются вращат. g -факторы и компоненты тензора c, а из них вычисляются электрич. квадру-польные моменты M. по ф-лам:
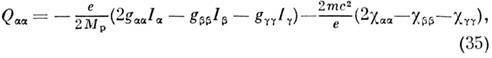
где
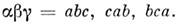
В вырожденных электронных состояниях зееманов-ская энергия определяется также ф-лой (32), в к-рой, однако, следует заменить ядерный магнетон m Я на магнетон Бора m Б и учесть, что g -факторы зависят от типа состояния и величины взаимодействия угл. моментов. Напр., в случае Хунда а в П- и D-состояниях двухатомной M. электронный магн. момент вдоль оси M. равен:
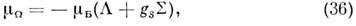
а электронный g -фактор
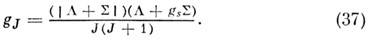
T. к. m Б/m Я ~ 103, зеемановские расщепления вращат. уровней энергии вырожденных электронных состояний наблюдаются и точно измеряются уже в полях в неск. десятков Гс. Поэтому методы, основанные на эффекте Зеемана (зеемановская модуляция в микроволновой спектроскопии и лазерный магн. резонанс), используются для изучения радикалов и ионов с открытыми электронными оболочками.
Распределение M. по квантовым состояниям и статистическая сумма. Согласно Максвелла - Больцмана распределению, при тепловом равновесии число M. Nn в состоянии с энергией
 и статистическим весом gn пропорц. величине
и статистическим весом gn пропорц. величине 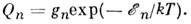
При T
 300 К (Tk
300 К (Tk 200 см -1) подавляющее большинство M. находится в основном электронном состоянии и распределено по вращат. уровням основного ко-лебат. состояния, а их небольшая часть - по уровням НЧ-колебаний (т. е. по уровням с энергией до 500- 700 см -1). Если M. не содержит ядер с отличным от нуля спином, то величина gn равна числу состояний с различными магн. квантовыми числами m, T. е. gJ == 2J + 1. В случае жёсткого сферич. волчка вращат. уровни вырождены ещё и по квантовому числу К проекции вращательного угл. момента J по одной из осей M. и gJ= (2J + 1)2. Если M. содержит ядра X, Y,... с ненулевыми спинами IX, IY, ..., но не содержит тождеств. ядер (напр., HCl, HCN), то статистич. веc содержит множитель (2IX + 1)(2IY + 1)..., одинаковый для всех вращат. уровней, к-рый не влияет на распределение M. по вращат. уровням. Для M., содержащих тождеств. ядра, статистич. веса уровней с различными J, К будут иметь разл. спиновые множители. Напр., отношение спиновых статистич. весов симметричных (J чётное) и антисимметричных (J нечётное) вращат. уровней двухатомной M., состоящей из одинаковых ядер со спином I, равно (I+1)/I, если I целое (I = 1, 2, 3...), или I/(I+1), если I полуцелое (I = 1/2, 3/2,...); если I = 0, то антисимметричные уровни отсутствуют.
200 см -1) подавляющее большинство M. находится в основном электронном состоянии и распределено по вращат. уровням основного ко-лебат. состояния, а их небольшая часть - по уровням НЧ-колебаний (т. е. по уровням с энергией до 500- 700 см -1). Если M. не содержит ядер с отличным от нуля спином, то величина gn равна числу состояний с различными магн. квантовыми числами m, T. е. gJ == 2J + 1. В случае жёсткого сферич. волчка вращат. уровни вырождены ещё и по квантовому числу К проекции вращательного угл. момента J по одной из осей M. и gJ= (2J + 1)2. Если M. содержит ядра X, Y,... с ненулевыми спинами IX, IY, ..., но не содержит тождеств. ядер (напр., HCl, HCN), то статистич. веc содержит множитель (2IX + 1)(2IY + 1)..., одинаковый для всех вращат. уровней, к-рый не влияет на распределение M. по вращат. уровням. Для M., содержащих тождеств. ядра, статистич. веса уровней с различными J, К будут иметь разл. спиновые множители. Напр., отношение спиновых статистич. весов симметричных (J чётное) и антисимметричных (J нечётное) вращат. уровней двухатомной M., состоящей из одинаковых ядер со спином I, равно (I+1)/I, если I целое (I = 1, 2, 3...), или I/(I+1), если I полуцелое (I = 1/2, 3/2,...); если I = 0, то антисимметричные уровни отсутствуют.Полное число M. в данном объёме пропорц. суммe величин Qn по всем состояниям M., т. е.
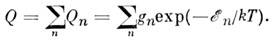
Величина Q наз. статистической суммой или суммой по состояниям, через неё могут быть выражены все термодинамич. ф-ции идеального газа, причём учитываются все степени свободы M., включая и её поступат. движение. Если не учитывать взаимодействие между видами внутр. движений M., то величину Q можно представить в виде произведения поступательной (Qt), вращательной (Qr), колебательной (Qu )и электронной (Qe )статистич. сумм:
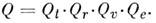
Статистич. сумма поступат. движения M. для объёма газа V и темп-ры T равна
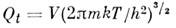
( т - масса M.). Вращат. статистич. сумма для жёсткой двухатомной или линейной многоатомной M. при kcB<< kT (без учёта ядерных спиновых статистич. весов)
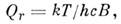
для M. типа жёсткого симметричного волчка
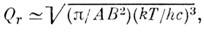
а для жёсткого асимметричного волчка
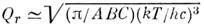
( А, В, С - вращат. постоянные). Колебат. статистич. сумма Qu. в гармонич. приближении выражается как произведение величин
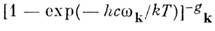
для каждого нормального колебания с частотой wk и кратностью вырождения gk. Если все возбуждённые электронные состояния M. сильно удалены от основного состояния (что справедливо для большинства устойчивых M.), можно положить Qe
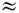 1.
1.T. о., если известны частоты нормальных колебаний и вращат. постоянные M., то можно найти полную статистич. сумму Q, а затем вычислить термодинамич. ф-ции газа. В частности, теплоёмкость С р одного моля газа при пост. давлении определяется по ф-ле
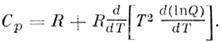
Лит.: Герцберг Г., Спектры и строение двухатомных молекул, пер. с англ., M., 1949; его же, Колебательные и вращательные спектры многоатомных молекул, пер. с англ., M., 1949; его же, Электронные спектры истроение многоатомных молекул, пер. с англ., M., 1969; его же, Спектры и строение простых свободных радикалов, пер. с англ., M., 1974; Ta-унс Ч., Шавлов А., Радиоспектроскопия, пер. с англ., M., 1959; Вильсон E., Дешиус Д ж., Кросс П., Теория колебательных спектров молекул, пер. с англ., M., 1960; Ельяшевич M. А., Атомная и молекулярная спектроскопия, M., 1962; Gordy W., Cook R. L., Microwave molecular spectra, 3 ed., N. Y., 1984; Wоllrab J. E., Rotational spectra and molecular structure, N. Y.- L., 1967;Molecular spectroscopy: modern research, v. 1-3, N. Y. - L., 1972-85; Papousek D., Aliev M. R., Molecular vibratiqnal/rota-tional spectra, Prague, 1982; Hirota E., High-resolution spectroscopy of transient molecules, B.- [a. o.l, 1985. M. P. Алиев.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
