- Оксид меди(I)
-
Оксид меди(I) 
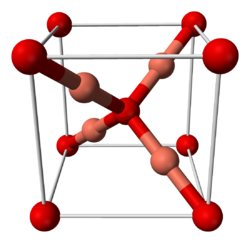
Систематическое название Оксид меди(I)
Другие названия Закись меди, гемиоксид меди, оксид димеди
Химическая формула Cu2O
Внешний вид Коричнево-красные кристаллы
Свойства Молярная масса Температура плавления 1242 °C (1515.15 К)
Температура разложения 1800 °C (2073.15 К)
Плотность 6,1 г/см³
Показатель преломления 2,85
Твёрдость по Моосу 3,5 — 4
Растворимость в воде 2,4·10−7 г/100 мл
Произведение растворимости 1,2·10−15
Токсикологические данные LD50 470 мг/кг
ПДК 0,1 мг/м3(в воздухе рабочей зоны);
0,003 мг/м3(в атмосфере);
0,1 мг/л (в воде)Структура Кристаллическая решётка Термодинамические свойства Стандартная энтальпия образования −171 кДж/моль
Энтальпия плавления +64,22 кДж/моль
Стандартная молярная энтропия +92 Дж/(моль·К)
Стандартная энергия образования Гиббса −148 кДж/моль
Классификация Регистрационный номер CAS 1317-39-1
Регистрационный номер EC Код SMILES [Cu]O[Cu]
Безопасность R-фразы R22; R50/53
S-фразы S22; S60; S61
H-фразы H302; H410
P-фразы P273; P501
Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). Окси́д ме́ди(I) (гемиокси́д ме́ди, окси́д диме́ди, устар. за́кись ме́ди) — химическое вещество с формулой
 . Соединение меди с кислородом, амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта.
. Соединение меди с кислородом, амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта.Содержание
Нахождение в природе
Оксид меди(I) встречается в природе в виде минерала куприта (устаревшие названия: красная медная руда, стекловатая медная руда, рубиновая медь). Цвет минерала красный, коричнево-красный, пурпурно-красный или чёрный. Твёрдость по шкале Мооса 3,5 — 4.[1]
Разновидность куприта с удлиненными нитевидными кристаллами называется халькотрихит (устаревшее название: плюшевая медная руда). Кирпично-красная смесь куприта с лимонитом носит название «черепичная руда».[2]
Физические свойства
Оксид меди(I) при нормальных условиях — твёрдое вещество коричнево-красного цвета нерастворимое в воде и этаноле. Плавится без разложения при 1242 °C.[2][3]
Оксид меди(I) имеет кубическую сингонию кристаллической решётки, пространственная группа P n3m, a = 0,4270 нм, Z = 2.[4]
Химические свойства
Реакции в водных растворах
Оксид меди(I) не реагирует с водой. В очень малой степени (ПР = 1,2·10−15) диссоциирует:
Оксид меди(I) переводится в раствор:
- концентрированной соляной кислотой
- концентрированной щёлочью (частично)
- концентрированным гидратом аммиака и концентрированными растворами солей аммония
- путём окисления до солей меди(II) различными окислителями (например, концентрированными азотной и серной кислотами, кислородом в разбавленной соляной кислоте)
Также оксид меди(I) вступает в водных растворах в следующие реакции:
- медленно окисляется кислородом до гидроксида меди(II)
- реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди(I):
- в разбавленной серной кислоте дисмутирует на сульфат меди(II) и металлическую медь
- восстанавливается до металлической меди типичными восстановителями, например гидросульфитом натрия в концентрированном растворе
Реакции при высоких температурах
Оксид меди(I) восстанавливается до металлической меди в следующих реакциях:
- при нагревании до 1800 °C (разложение)
- при нагревании в токе водорода, монооксида углерода, с алюминием
- при нагревании с серой
Оксид меди(I) может быть окислен до соединений меди(II) в токе кислорода или хлора:
Также, при высоких температурах оксид меди(I) реагирует:
- с аммиаком (образуется нитрид меди(I))
- c оксидами щелочных металлов и бария (образуются двойные оксиды)
Прочие реакции
Оксид меди(I) реагирует с азидоводородом:
- при охлаждении выпадает осадок азида меди(II)
- при комнатной температуре в токе азота выпадает осадок азида меди(I)
Получение
Оксид меди(I) может быть получен:
- нагреванием металлической меди в токе оксида азота(I) или оксида азота(II)
- нагреванием металлической меди с оксидом меди(II)
- термическим разложением оксида меди(II)
- нагреванием сульфида меди(I) в токе кислорода
В лабораторных условиях оксид меди(I) может быть получен восстановлением гидроксида меди(II) (например, гидразином):
Также, оксид меди(I) образуется в реакциях ионного обмена солей меди(I) с щелочами, например:
- в реакции иодида меди(I) с горячим концетрированным раствором гидроксида калия
- в реакции дихлорокупрата(I) водорода с разбавленным раствором гидроксида натрия
В двух последних реакциях не образуется соединения с составом, соответствующим формуле
 (гидроксид меди(I)). Образование оксида меди(I) происходит через промежуточную гидратную форму переменного состава
(гидроксид меди(I)). Образование оксида меди(I) происходит через промежуточную гидратную форму переменного состава  .[5]
.[5]Применение
Оксид меди(I) применяется как пигмент для окрашивания стекла, керамики, глазурей; как компонент красок, защищающих подводную часть судна от обрастания; в качестве фунгицида.[4]
Обладает полупроводниковыми свойствами, используется в меднозакисных вентилях.
Токсичность
Оксид меди(I) — умеренно токсичное вещество: LD50 470 мг/кг (для крыс перорально). Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Очень токсично для водной среды: Daphnia magna составляет 0,5 мг/л в течение 48 ч.
Примечания
- ↑ Куприт на webmineral.com
- ↑ 1 2 Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 104, 226, 464, 532, 604. — 685 с. — ISBN 5-7107-8085-5
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 148—149. — 637 с. — ISBN 978-5-358-01303-2
- ↑ 1 2 Оксиды меди на xumuk.ru. Архивировано из первоисточника 15 февраля 2012.
- ↑ Гидроксиды меди на xumuk.ru. Архивировано из первоисточника 15 февраля 2012.
Соединения медиАзид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) •
Категории:- Соединения меди
- Оксиды меди
- Фунгициды
Wikimedia Foundation. 2010.






![\mathsf{Cu_2O\ +\ 4HCl\ \longrightarrow\ 2H[CuCl_2]\ +\ H_2O}](170658064b04870b487d8b358205d0f9.png)
![\mathsf{Cu_2O\ +\ 2OH^-\ +\ H_2O\ \rightleftarrows\ 2[Cu(OH)_2]^-}](a682b580f4aa8e21b86ebbd200d98007.png)
![\mathsf{Cu_2O\ +\ 4(NH_3 \cdot H_2O)\ \longrightarrow\ 2[Cu(NH_3)_2]OH\ +\ 3H_2O}](14e2ef809504552410ed1ae7eaddf512.png)
![\mathsf{Cu_2O\ +\ 2NH_4^+\ \longrightarrow\ 2[Cu(H_2O)(NH_3)]^+}](73c702894fb1c0b17e366b00b65ad9eb.png)




























![\mathsf{2H[CuCl_2]\ +\ 4NaOH\ \longrightarrow\ Cu_2O \downarrow +\ 4NaCl\ +\ 3H_2O}](e585745161bd2694d87e6f8e28bb8f1c.png)