- Оксид хлора(VII)
-
Оксид хлора(VII) 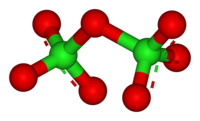
Общие Систематическое наименование Оксид хлора(VII) Химическая формула Cl2O7 Физические свойства Состояние (ст. усл.) жидкость Отн. молек. масса 182,901 а. е. м. Молярная масса 182.901 г/моль Термические свойства Температура плавления −91,5 °C Температура кипения 82 °C Температура разложения 120 °C Классификация Рег. номер CAS [12015-53-1]
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид.Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0,1709 нм, в группах ClО3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C2, молекула полярна (μ = 2,40·10−30 Кл·м).
Свойства
Хлорный ангидрид представляет собой бесцветную маслянистую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:
-
 ΔH = 135 кДж/моль
ΔH = 135 кДж/моль
Медленно растворяется в холодной воде, образуя хлорную кислоту:
Хлорный ангидрид является сильным окислителем.
Получение
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
 Категория:
Категория:- Оксиды хлора
-
Wikimedia Foundation. 2010.


