- Хлорид меди(I)
-
Хлорид меди(I) 
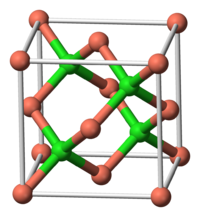
Общие Систематическое наименование Хлорид меди(I) Традиционные названия Хлористая медь Химическая формула CuCl Физические свойства Состояние (ст. усл.) твёрдое Молярная масса 98.999 г/моль Плотность 4.145 г/см³ Термические свойства Температура плавления 426 °C Температура кипения 1490 °C Химические свойства Растворимость в воде 0.0062 г/100 мл Оптические свойства Показатель преломления 1.930 Структура Кристаллическая структура Структура цинковой обманки Классификация Рег. номер CAS 7758-89-6 Рег. номер EINECS 231-842-9 SMILES [Cu+]-[Cl-] RTECS GL6990000 Безопасность ЛД50 140 мг/кг Токсичность Хлори́д ме́ди(I) — бинарное химическое соединение, медная соль хлороводородной кислоты.
Представляет собой белый или зеленоватый порошок, практически нерастворимый в воде (0,0062 г/100 мл при 20 °C). Зеленоватую окраску придают примеси хлорида меди(II).
Содержание
История открытия
Впервые хлорид меди(I) был получен Робертом Бойлем в 1666 году, из хлорида ртути(II) и металлической меди:
В 1799 году, Джозеф Луи Пруст успешно отделил дихлорид меди от монохлорида и описал эти соединения. Это было достигнуто путем нагревания CuCl2 в бескислородной среде, в результате чего хлорид меди(II) потерял половину связанного хлора. После этого он удалил остатки дихлорида меди от хлорида меди(I) и промыл водой.
Физические свойства
Монохлорид меди образует кристаллы белого цвета, кубической сингонии, пространственная группа F 43m, a = 0,5418 нм, Z = 4, структура типа ZnS. При нагревании кристаллы синеют. При температуре 408 °C CuCl переходит в гексагональную модификацию, пространственная группа P 63mc, a = 0,391 нм, c = 0,642 нм, Z = 4.
Монохлорид меди плавится и кипит без разложения. В пара́х молекулы полностью ассоциированы (димеры с незначительной примесью тримеров), поэтому формулу вещества иногда записывают как Cu2Cl2.
Монохлорид меди плохо растворим в воде (0,062% при 20 °C), но хорошо в растворах хлоридов щелочных металлов и соляной кислоте. Так в насыщенном растворе NaCl растворимость CuCl составляет 8% при 40 °C и 15% при 90 °C. Водный раствор аммиака растворяет CuCl с образованием бесцветного комплексного соединения [Cu(NH3)2]Cl.
Получение
В природе монохлорид меди встречается в виде редкого минерала нантокит (по названию села Нантоко, Чили), который благодаря подмеси атакамита часто окрашен в зелёный цвет.
В промышленности монохлорид меди получают несколькими способами:
хлорирование избытка меди, взвешенной в расплавленном CuCl:
восстановление CuCl2 медью в подкисленном растворе:
В лабораторной практике последний метод также широко распространён. Очень чистый препарат получается при взаимодействии меди с газообразным хлористым водородом:
Похожая реакция идёт в растворе в присутствии окислителей (O2, HNO3, KClO3):
удобен способ восстановления меди(II) двуокисью серы:
а ещё удобнее—восстановление сульфитом при избытке хлоридов:
возможна реакция обратного диспропорционирования:
возможно получение монохлорида меди термическим разложением дихлорида:
Химические свойства
При кипячении суспензии монохлорида меди происходит реакция диспропорционирования:
Монохлорид меди обратимо растворяется в соляной кислоте с образованием комплексного соединения:
Монохлорид меди устойчив в сухом вохдухе, но во влажном начинает окисляться до основного хлорида (который и придаёт кристаллам зелёный цвет):
В кислой среде окисление приводит к образованию нормальных солей:
Окисление можно проводить и горячей концентрированной азотной кислотой:
Аммиачные растворы монохлорида меди поглощают ацетилен с образованием красного осадка:
Кислые растворы монохлорида меди обратимо поглощают окись углерода:
Применение
- Монохлорид меди — промежуточный продукт при производстве меди.
- Поглотитель газов при очистке ацетилена, а также CO в газовом анализе.
- Катализатор в органическом синтезе, например при окислительном хлорировании метана или этилена, в производстве акрилонитрила.
- Антиоксидант для растворов целлюлозы.
Монохлорид меди, как и все соединения меди, токсичен.
Литература
- Г. Реми Курс неорганической химии. — М.: Мир, 1966. — Т. 2. — 837 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Фурман А. А. Неорганические хлориды (химия и технология). — М.: Химия, 1980. — 416 с.
- Химическая энциклопедия / Под ред. Кнунянц И. Л. и др.. — М.: Большая российская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-85270-039-8
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Соединения медиАзид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) •
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Категории:- Соединения меди
- Бинарные соединения
- Хлориды
Wikimedia Foundation. 2010.













![\mathsf{CuCl + HCl \ \rightleftarrows \ H[CuCl_2]}](58c126ddf5266cec990460f7996a2d52.png)




