- Этилнитрат
-
Для улучшения этой статьи желательно?: - Переработать оформление в соответствии с правилами написания статей.
- Исправить статью согласно стилистическим правилам Википедии.
- Викифицировать статью.
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Этилнитрат 
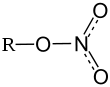
Общие Систематическое наименование ethyl nitrate, этилнитрат Химическая формула Брутто-формула (система Хилла) C2H5NO3 Формула в виде текста: C2H5ONO2 Физические свойства Состояние (ст. усл.) жидкое Молярная масса 91.066 г/моль Плотность d204 = 1,1084 г/см3 [1], 1,1076 г/см3 [3] г/см³ Термические свойства Температура плавления -94,6[1]°C, -102 [2] °C Температура кипения 87,2 °C[1] °C Химические свойства Растворимость в воде 1,335 3,0955 эт. сп.: эф. г/100 мл Вращение [α]D 1,385221,5 [1]° Классификация Рег. номер CAS 625-58-1 Этилнитрат (ethyl nitrate, nitric ethyl ester, этилнитрат, этиловый эфир азотной кислоты) — C2H5ONO2, сложный эфир этилового спирта и азотной кислоты, типичный представитель класса сложных эфиров. Применяется в органическом синтезе в качестве нитрующего агента, в том числе для получения лекарственных препаратов и красителей.
Содержание
Физические свойства
Бесцветная, легко подвижная жидкость с приятным запахом, Тпл −94,6 °C[1], −102 °C[2], Ткип 87,2 °C[1], (74,35 °C (температура кипения азеотропа, давление 1 атм) вода 22% этилнитрат 78%) (61,77 °C (температура кипения азеотропа, давление 1 атм) метиловый спирт 57% этилнитрат 43%), d204 1,1084 г/см3 [1], 1,1076 г/см3 [3] n20D 1,3852[1] ΔHобр -499,5 ккал/кг [2]. Этилнитрат плохо растворяется в воде (1,3 г/100 мл при 35 °C и 3,09 г/100мл 55 °C) [вставить ссылку], хорошо в спирте и большинстве органических растворителей, образует азеотропные смеси (с 22% воды Ткип 74,35 °C, с 57% метилового спирта Ткип 61,77 °C) [вставить ссылку]
Химические свойства
В кислой и щелочной среде этилнитрат легко гидролизуется с образованием этилового спирта. В присутствии оснований этилнитрат способен нитровать амины, ароматические и алифатические соединения, содержащие активные СН2-группы, а также может выступать в качестве алкилирующего агента для аминов, сульфидов, азидов и некоторых других соединений [1,3]. Восстановление этилнитрата различными реагентами, такими как FeCl2, LiAlH4, N2H4 и некоторыми другими, приводит к образованию этанола с высокими выходами [3].
Физиологическое действие
Действие этилнитрата сходно с действием других эфиров азотной кислоты (Нитроглицерин, Эринит, мононитроизосорбид) и азотистой кислоты, как например амилнитрита. В организме расщепляется до NO, который катализирует выделение циклического гуанозинмонофосфата, являющегося вазодилататом, в результате чего Этилнитрат, как и остальные нитраты и нитриты, оказывает сосудорасширяющее действие, в основном на вены. Это приводит к головным болям и тахикардии у работающих с подобными веществами. Так же этилнитрат токсичен, способен окислять гемоглобин в метгемоглобин, вызывает головную боль, головокружение и учащенное сердцебиение [1,3].
Взрывчатые характеристики
Этилнитрат взрывоопасен, скорость детонации 5800 м/сек (при плотности 1,1 г/см3)[2]. Расширение в свинцовой бомбе 420 см3/10 г[2], 345мл [вставить ссылку], теплота взрыва (Н2Ож) 993 ккал/кг[2], в непрочной оболочке детонирует неустойчиво, в прочной оболочке (стальная труба диаметром 27 мм, толщина стенки 3 мм) устойчивая детонация возникает от промежуточного детонатора, содержащего 40 г ТЭНа [вставить ссылку]. Этилнитрат способен взрываться при контакте со щелочными металлами, легко образует взрывчатые смеси с воздухом при комнатной температуре нижний КПВ 3.8% [1,2].
Получение
1. 200г чистой азотной кислоты (1,4) кипятят с 2г азотнокислой мочевины, охлаждают и смешивают с 150г абсолютного спирта. После прибавления 50г азотнокислой мочевины отгоняют на водяной бане примерно 2/3 жидкости, в перегонную колбу по каплям приливают равный отогнанному объем смеси 4 частей азотной кислоты, прокипяченной с 1% мочевины, и 3 частей спирта. С помощью указанного количества мочевины можно получить 2-3кг этилнитрата. Продукт выделяют водой сушат хлористым кальцием и перегоняют на водяной бане. Температура кипения 86 °C [4]
Источники
- «Химический энциклопедический словарь» М. «Советская энциклопедия» 1983
- «Explosives» Fifth Ed. 2002 Wiley-VCH Verlag GmbH & Co.KGaA
- «Химическая энциклопедия в пяти томах» Т.3. Изд. «Большая Российская энциклопедия» 1992.
- Губен И. «Методы органической химии» Т. III. Вып. 1. М-Л., Госхимиздат 1934.
Губен И. «Методы органической химии» Т. IV. Вып. 1. книга первая. М-Л., Госхимиздат. 1949
- G. Hetherington and R. L. Robinson "Nitryl fluoride as a nitrating agent". J. Chem. Soc. 1954, 3512.
НитратыДинитрат гидразина (N2H6(NO3)2) • Изопентилнитрат ((CH3)2CHCH2CH2ONO2) • Метилнитрат (CH3ONO2) • Нитрат актиния(III) (Ac(NO3)3) • Нитрат алюминия (Al(NO3)3) • Нитрат аммония (NH4NO3) • Нитрат бария (Ba(NO3)2) • Нитрат берилия (Be(NO3)2) • Нитрат висмута (Bi(NO3)3) • Нитрат гадолиния (Gd(NO3)3) • Нитрат гидразина (N2H5NO3) • Нитрат гидроксиламина ((NH3OH)NO3) • Нитрат гуанидина (C(NH2)3NO3) • Нитрат железа(III) (Fe(NO3)3) • Нитрат кадмия (Cd(NO3)2) • Нитрат калия (KNO3) • Нитрат кальция (Са(NО3)2) • Нитрат кобальта(II) (Co(NO3)2) • Нитрат кобальта(III) (Co(NO3)3) • Нитрат лития (LiNO3) • Нитрат магния (Mg(NO3)2) • Нитрат марганца (Mn(NO3)2) • Нитрат меди(II) (Cu(NO3)2) • Нитрат мочевины ((NH2)2CO•HNO3) • Нитрат натрия (NaNO3) • Нитрат неодима (Nd(NO3)3) • Нитрат никеля(II) (Ni(NO3)2) • Нитрат палладия(II) (Pd(NO3)3) • Нитрат ртути(I) (Hg2(NO3)2) • Нитрат ртути(II) (Hg(NO3)2) • Нитрат рубидия (RbNO3) • Нитрат свинца(II) (Pb(NO3)2) • Нитрат серебра(I) (AgNO3) • Нитрат скандия(III) (Sc(NO3)3) • Нитрат стронция (Sr(NO3)2) • Нитрат урана (U(NO3)2) • Нитрат уранила (UO2(NO3)2) • Нитрат хлорина (ClONO3) • Нитрат хрома (Cr(NO3)3) • Нитрат цезия (CsNO3) • Нитрат цинка (Zn(NO3)2) • Нитраты целлюлозы ([C6H7O2(OH)3-x(ONO2)x]n) • Нитроглицерин (O2NOCH(CH2ONO2)2) • Пропилнитрат (C3H7ONO2) • Церий-аммоний нитрат ((NH4)2Ce(NO3)6) • Этилнитрат (C2H5ONO2)
 Категории:
Категории:- Нитраты
- Взрывчатые вещества
- Этилнитрат
Wikimedia Foundation. 2010.
