- Молекулярные орбитали
-
 Молекулярная орбиталь пероксида водорода
Молекулярная орбиталь пероксида водородаТеория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул. В этой теории квантово-механические зависимости для атома распространены на более сложную систему — молекулу. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные энергетические состояния отдельных электронов (молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы.
Предполагается, что все электроны — данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Состояние электрона в атоме описывается одноэлектронной волновой функцией ψ, являющейся решением уравнения Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая конкретный математический вид и удовлетворяющая условию нормировки и однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной). Каждая орбиталь характеризуется своим набором квантовых чисел, отражающих свойства электронов в данном энергетическом состоянии. В отличие от одноцентровых орбиталей атомов, орбитали молекул многоцентровые, то есть молекулы имеют общие орбитали для двух или более атомных ядер. Каждая молекулярная орбиталь обладает определённой энергией, приближённо характеризующейся соответствующим потенциалом ионизации.
По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-, γ-. МО образуются при комбинировании атомных орбиталей при достаточном сближении. Совокупность МО молекулы с указанием её типа и количеством электронов на ней даёт электронную конфигурацию молекулы. Существуют 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участие в образовании химической связи не принимают. Из исходных атомных орбиталей возникает nМО. Так, при образовании двухатомной молекулы H2 из атомов Н из s-орбиталей двух атомов Н возникают две двухцентровые МО — одна энергетически более выгодная (связывающая σsсв), другая менее выгодная (разрыхляющая σsразр), чем исходные атомные орбитали. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. Нa разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга.
Характер распределения электронов по МО определяет порядок (кратность) связи, ее энергию, межъядерные расстояния (длина связи), магнитные свойства молекул и др. Заполнение молекулярных орбиталей подчиняется тем же правилам, что и заполнение атомных: принципу энергетической выгодности, принципу Паули, правилу Хунда, принципу заполнения электронных структур Aufbau. В общепринятом приближении молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей (приближение МО ЛКАО).
Кратность связи в теории молекулярных орбиталей определяется выражением
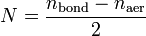
где
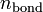 и
и 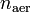 — суммарные количества электронов на связывающих и разрыхляющих орбиталях соответственно.
— суммарные количества электронов на связывающих и разрыхляющих орбиталях соответственно.Содержание
Пример
Рассмотрим на примере молекулы водорода. У двух атомов водорода 2 1S орбитали с 1 электроном на каждой. Они имеют одинаковую энергию. Далее по приближению МО ЛКАО эти две орбитали преобразуются на 2: связывающую и разрыхляющую. Причём связывающая находится по энергии ниже 1s орбиталей водородов на ΔE. Разрыхляющая орбиталь находится выше 1s орбиталей на ΔE. Пусть 1S орбитали водородов имеют энергию Е, тогда связывающая орбиталь имеет энергию E — ΔE, разрыхляющая E + ΔE. Сложим энергии этих двух орбиталей (E — ΔE) + (E + ΔE) = 2E , что соответствует двум 1s орбиталям двух атомов водорода. То есть закон сохранения энергии выполняется (что и должно быть).
Еще один пример
Хорошим примером работы метода молекулярных орбиталей может явится рассмотрение молекулы кислорода
 . В ней имеется одна σ-связь, т.е. одна σ-связывающая и одна σ-разрыхляющая орбитали. Общее же число орбиталей равно 8, т.к. число орбиталей валентного (высшего) уровня атома кислорода равно 4. Таким образом, число π-связывающих орбиталей равно
. В ней имеется одна σ-связь, т.е. одна σ-связывающая и одна σ-разрыхляющая орбитали. Общее же число орбиталей равно 8, т.к. число орбиталей валентного (высшего) уровня атома кислорода равно 4. Таким образом, число π-связывающих орбиталей равно 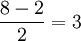 , и, соответственно, имеется столько же разрыхляющих π-орбиталей. Энергия π-орбиталей, как правило, меньше, чем у σ-орбиталей (из-за их, π-орбиталей, большего "размера"), так что они заполняются раньше. Общее число электронов на орбиталях молекулы кислорода равно 12 (по 6 от каждого атома кислорода). Первые 6 электронов размещаются на 3 связывающих π-орбиталях. (Необходимо помнить, что заполнение молекулярных, как и атомных орбиталей, происходит в соответствии с принципом Паули и правилом Хунда!) Следующие два — на (одной) связывающей σ-орбитали. Остается 4 электрона. Сначала 3 из них заселяют 3 разрыхляющих π-орбитали, по одному на каждую (по правилу Хунда). Послений завершает заселение одной из них (они, понятно, равноценны). В молекуле кислорода оказываются 2 неспаренных электрона. Таким образом, метод молекулярных орбиталей наличием этих неспаренных электронов объясняет наблюдающийся на практике парамагнетизм кислорода — в отличие от метода валентных связей, который не приводит к подобному результату. Согласно ММО, кратность связи в молекуле кислорода равна
, и, соответственно, имеется столько же разрыхляющих π-орбиталей. Энергия π-орбиталей, как правило, меньше, чем у σ-орбиталей (из-за их, π-орбиталей, большего "размера"), так что они заполняются раньше. Общее число электронов на орбиталях молекулы кислорода равно 12 (по 6 от каждого атома кислорода). Первые 6 электронов размещаются на 3 связывающих π-орбиталях. (Необходимо помнить, что заполнение молекулярных, как и атомных орбиталей, происходит в соответствии с принципом Паули и правилом Хунда!) Следующие два — на (одной) связывающей σ-орбитали. Остается 4 электрона. Сначала 3 из них заселяют 3 разрыхляющих π-орбитали, по одному на каждую (по правилу Хунда). Послений завершает заселение одной из них (они, понятно, равноценны). В молекуле кислорода оказываются 2 неспаренных электрона. Таким образом, метод молекулярных орбиталей наличием этих неспаренных электронов объясняет наблюдающийся на практике парамагнетизм кислорода — в отличие от метода валентных связей, который не приводит к подобному результату. Согласно ММО, кратность связи в молекуле кислорода равна 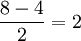 , т.е. связь двойная.
, т.е. связь двойная.Преимущества
По сравнению с методом валентных схем имеет следующие преимущества:
1. Позволяет описывать химическую связь в электронодефицитных молекулах (диборан), молекулах радикалах (монооксид азота), молекулярных ионах (нитрозил, нитроил, гидразоний, оксигенил), гипервалентных соединениях (соединения благородных газов)
2. Обьясняет образование молекул с многоцентровыми орбиталями. Например, в азотной кислоте азот имеет формально валентность 5, хотя не может образовывать 5 связей. Этот парадокс обьясняется наличием трёхцентровой двухэлектронной связи.
Когда обнаружилась способность благородных газов образовывать соединения, некоторые учёные были склонны считать что электроны распариваются на следующий энергетический уровень и образуются нормальные двухцентровые двухэлектронные связи. Однако энергия на распаривание слишком велика, и она не покрылась бы энергией, выделившейся в результате образования химических связей. Оказывется, образуются трёхцентровые четырёхэлектронные связи. Модель МО ЛКАО позволяет объяснить образование химической связи в такого рода соединениях.
Энергию МО в молекуле либо определяют экспериментально (спектроскопически и др.) либо рассчитывают методами квантовой механики и квантовой химии (чисто теоретическими и полуэмпирическими).
См. также
Посмотрите ссылки
Метод молекулярных орбиталей в качественном изложении, с диаграммами:[1]
Литература
- Фудзинага С. Метод молекулярных орбиталей. М.: Мир, 1983. 462 с.
- Дьюар М. Теория молекулярных орбиталей в органической химии. М.: Мир, 1972. 592 с.
- Волков А. И. Метод молекулярных орбиталей М.: Новое знание, 2006. 136 с. ISBN 5-94735-107-2
- Дьюар М., Догерти Р. Теория возмущений молекулярных орбиталей в органической химии. М.: Мир, 1970. 695 c.
- Базилевский М. В. Метод молекулярных орбит и реакционная способность органических молекул. М.: Химия, 1969. 304 с.
Wikimedia Foundation. 2010.
