- АДСОРБЦИЯ
- АДСОРБЦИЯ
-
(от лат. ad — на, при и sorbeo — поглощаю), процесс, приводящий к аномально высокой концентрации в-ва (а д с о р б а т а) из газообразной или жидкой среды на поверхности её раздела с жидкостью или тв. телом (а д с о р б е н т о м). Частный случай сорбции. А. происходит под действием некомпенсированных сил межмол. вз-ствия в поверхностном слое адсорбента, что вызывает притяжение молекул адсорбата из приповерхностной области; А. приводит к уменьшению поверхностной энергии.В зависимости от хар-ра вз-ствия молекул адсорбента и адсорбата различают физ. А. и хемосорбцию. Физ. А. не сопровождается хим. изменениями молекул. При такой А. молекулы могут образовывать не только мономол. слой, но и адсорбироваться многослойно, а также мигрировать по поверхности. Процессы хемосорбции сопровождаются образованием связи между молекулами адсорбента и адсорбата.Адсорбиров. молекулы через не-крое время (время А.) покидают поверхность адсорбата — д е с о р б и р у ю т с я. Кол-во молекул, адсорбирующихся (десорбирующихся) в ед. времени на ед. поверхности (с ед. поверхности), наз. скоростью А. (скоростью десорбции). При равенстве скорости А. и десорбции имеет место а д с о р б ц и о н н о е р а в н о в е с и е. С ростом темп-ры время физ. А. и кол-во адсорбиров. молекул уменьшается, в то время как скорость хемосорбции обычно возрастает. Скорость А. повышается с увеличением концентрации и, следовательно, давления адсорбата в объёме.Зависимость равновесной А. от концентрации (давления) адсорбата при пост. темп-ре наз. изотермами А. Для описания монослойного покрытия поверхности адсорбента в системе газ — тв. тело существует несколько осн. типов изотерм А.; наиб, общая — изотерма Ленгмюра: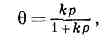 где р — давление, q — относит, степень заполнения поверхности адсорбиров. молекулами, k — константа, зависящая от темп-ры и характера вз-ствия между ч-цами адсорбента и адсорбата. Изотерма Ленгмюра может служить для описания как физ. А., так и хемосорбции, однако область её применения ограничена, как правило, низкими степенями заполнения, при к-рых молекулы адсорбата не взаимодействуют между собой. При более высоких значениях в молекулы адсорбата притягиваются не только молекулами адсорбента, но и друг к другу, поэтому по мере заполнения поверхности условия для А. становятся всё более благоприятными и 6 резко возрастает с повышением р, но при степенях заполнения, близких к единице, рост А. резко замедляется. При дальнейшем увеличении давления происходит заполнение 2-го, 3-го и т. д. слоев молекулами адсорбата (полимолекулярная А.). Если адсорбент имеет пористую структуру и его поверхность явл. смачиваемой по отношению к адсорбату, то происходит капиллярная конденсация.Процесс А. сопровождается выделением тепла, наз. теплотой А., к-рая тем больше, чем прочнее связь между молекулами адсорбента и адсорбата. Теплота физ. А. составляет, как правило, 8—25 кДж/моль, теплота хемосорбции превышает 80 кДж/моль. По мере заполнения однородной поверхности теплота А. обычно уменьшается. При переходе к полимол. А. теплота А. понижается до величины, близкой к теплоте конденсации адсорбата.А. играет важную роль в процессах теплообмена, разделения газовых и жидких смесей, в биохим. системах. Она явл. важнейшей стадией образования гетерогенных систем и гл. фактором в стабилизации дисперсных систем. А. проявляется во всех процессах, где существенны поверхностные св-ва в-в (см. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ).
где р — давление, q — относит, степень заполнения поверхности адсорбиров. молекулами, k — константа, зависящая от темп-ры и характера вз-ствия между ч-цами адсорбента и адсорбата. Изотерма Ленгмюра может служить для описания как физ. А., так и хемосорбции, однако область её применения ограничена, как правило, низкими степенями заполнения, при к-рых молекулы адсорбата не взаимодействуют между собой. При более высоких значениях в молекулы адсорбата притягиваются не только молекулами адсорбента, но и друг к другу, поэтому по мере заполнения поверхности условия для А. становятся всё более благоприятными и 6 резко возрастает с повышением р, но при степенях заполнения, близких к единице, рост А. резко замедляется. При дальнейшем увеличении давления происходит заполнение 2-го, 3-го и т. д. слоев молекулами адсорбата (полимолекулярная А.). Если адсорбент имеет пористую структуру и его поверхность явл. смачиваемой по отношению к адсорбату, то происходит капиллярная конденсация.Процесс А. сопровождается выделением тепла, наз. теплотой А., к-рая тем больше, чем прочнее связь между молекулами адсорбента и адсорбата. Теплота физ. А. составляет, как правило, 8—25 кДж/моль, теплота хемосорбции превышает 80 кДж/моль. По мере заполнения однородной поверхности теплота А. обычно уменьшается. При переходе к полимол. А. теплота А. понижается до величины, близкой к теплоте конденсации адсорбата.А. играет важную роль в процессах теплообмена, разделения газовых и жидких смесей, в биохим. системах. Она явл. важнейшей стадией образования гетерогенных систем и гл. фактором в стабилизации дисперсных систем. А. проявляется во всех процессах, где существенны поверхностные св-ва в-в (см. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ).
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- АДСОРБЦИЯ
-
(от лат. ad - на, при и sorbeo - поглощаю) - преимущественное концентрирование молекул газа или растворённого в жидкости вещества (адсорбата) на поверхности жидкости или твёрдого тела (адсорбента), а также растворённого в жидкости вещества на границе её раздела с газовой фазой. Частный случай сорбции. Один из важнейших типов поверхностных явлений.
Явление А. связано с тем, что силы межмолекулярного взаимодействия на границе раздела фаз не скомпенсированы, и, следовательно, пограничный слой обладает избытком энергии - свободной поверхностной энергией. В результате притяжения поверхностью раздела фаз находящихся вблизи неё молекул адсорбата свободная поверхностная энергия уменьшается, т. е. процессы А. энергетически выгодны.
В зависимости от характера взаимодействия молекул адсорбата и адсорбента различают физическую А. и хемосорбцию. Физ. А. обусловлена силами межмолекулярного взаимодействия и не сопровождается существ. изменением электронной структуры молекул адсорбата. Физ. А. может быть как мо-нослойной (с образованием мономолекулярного слоя), так и полимолекулярной (многослойной). При А. электролитов из их растворов обычно возникает двойной электрический слой. Если жидкий адсорбат смачивает пористый адсорбент, то в порах последнего может происходить капиллярная конденсация. При физ. А. адсорбир. молекулы обычно обладают поверхностной подвижностью.
При хемосорбции между атомами (молекулами) адсорбента и адсорбата образуется хим. связь, т. о. хемосорбцию можно рассматривать как хим. реакцию, область протекания к-рой ограничена поверхностным слоем. В нек-рых случаях на одной поверхности могут протекать оба типа А. одновременно. В случае не слишком пористых адсорбентов физ. А. имеет место, как правило, при темп-pax ниже критич. темп-ры конденсации адсорбата, хемосорбция же чаще всего протекает при гораздо более высоких темп-рах. Однако в нек-рых системах физ. А. может протекать при темп-pax, значительно превышающих критич. темп-ру конденсации адсорбата. Как и любые хим. реакции, процессы хемосорбции носят специфичный характер (т. е. адсорбент хемосорбирует не любые молекулы, а лишь те, к-рые вступают в реакцию с атомами поверхности); в нек-рых случаях специфичность может проявляться и при физ. А.
Физ. характеристики А. Количеств. характеристикой А. является величина Г, представляющая собой избыток адсорбата, приходящийся на единицу площади поверхностного слоя, по сравнению с кол-вом адсорбата в единицу объёма фазы адсорбента. Отношение
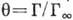 наз. степенью (или долей) покрытия поверхности (
наз. степенью (или долей) покрытия поверхности (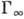 -предельно возможная величина монослой-ной А. для данной системы).
-предельно возможная величина монослой-ной А. для данной системы).Процессы А. почти всегда сопровождаются выделением теплоты, наз. теплотой А., к-рая возрастает с увеличением прочности связи адсорбат - адсорбент и составляет обычно 8-25 кДж/моль (иногда до 80 кДж/моль) для физ. А. и, как правило, превышает 80 кДж/моль при хемосорбции. Если хемосорбция сопровождается диссоциацией адсорбир. молекул, может наблюдаться поглощение тепла. По мере заполнения поверхности теплота А. обычно уменьшается в результате неоднородного распределения свободной энергии на поверхности или латерального взаимодействия молекул в адсорбир. слое. Для адсорбентов, обладающих неск. типами адсорбирующих центров (см. ниже), теплота А. может быть различной для разных типов центров, и распределение свободной энергии на поверхности является дискретно-неоднородным. При переходе к полимолекулярной А. теплота А. понижается до величины, близкой к теплоте конденсации адсорбата. Если теплота А. сравнима с поверхностной энергией адсорбента, то в процессе А. может существенно меняться кристаллич. структура поверхности твёрдого тела, причём при физ. А. перестройке подвергаются в осн. поверхности молекулярных кристаллов, а в случае хемосорбции изменение поверхностной структуры наблюдается даже для металлов и ионных кристаллов.
Обратный А. процесс, при к-ром адсорбир. частицы покидают поверхность адсорбента, наз. десорбцией. Десорбция происходит в результате колебат. движения адсорбир. молекул вдоль направления действия силы притяжения между адсорбатом и адсорбентом. Период таких колебаний t0 обычно составляет 10-13 с. Скорость А. и скорость десорбции могут быть рассчитаны методами статистич. термодинамики. Скорость медленных процессов хемосорбции в большинстве случаев описывается ур-нием
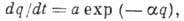
где
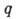 - кол-во адсорбир. вещества, а и
- кол-во адсорбир. вещества, а и 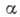 - константы, зависящие от темп-ры. При равенстве скоростей А. и десорбции устанавливается адсорбц. равновесие. Ср. продолжительность времени, к-рое частица находится в адсорбир. состоянии в равновесных условиях (время А.),
- константы, зависящие от темп-ры. При равенстве скоростей А. и десорбции устанавливается адсорбц. равновесие. Ср. продолжительность времени, к-рое частица находится в адсорбир. состоянии в равновесных условиях (время А.), 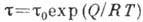 , где Q - теплота А., Л - универсальная газовая постоянная, Т - абс. темп-pa. Принято считать, что А. имеет место в том случае, когда
, где Q - теплота А., Л - универсальная газовая постоянная, Т - абс. темп-pa. Принято считать, что А. имеет место в том случае, когда 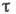 достигает величины неск. периодов колебаний адсорбир. молекулы - время, за к-рое между ней и поверхностью успевает установиться энергетич. равновесие. Обычно время физ. А. составляет 10-12-10-6 с, а время хемосорбции - св. 102 с. Время А. служит критерием обратимости процесса А.
достигает величины неск. периодов колебаний адсорбир. молекулы - время, за к-рое между ней и поверхностью успевает установиться энергетич. равновесие. Обычно время физ. А. составляет 10-12-10-6 с, а время хемосорбции - св. 102 с. Время А. служит критерием обратимости процесса А. Теория А. Единая теория, к-рая описывала бы любые процессы А., пока не создана; существующие частные теоретич. разработки основываются на разл. моделях. Модель локализованной (или центровой) А. предполагает наличие на поверхности адсорбента т. н. центров А., представляющих собой либо строго определ. участки поверхности, на к-рых образуется сильная адсорбц. связь, либо распределённые по поверхности двумерные ячейки со слабым адсорбц. полем (полем сил межмолекулярного взаимодействия). В последнем случае предполагается наличие плотной упаковки молекул адсорбата на поверхности в пределах рассматриваемой ячейки.
В основе модели двумерной фазы лежит положение о том, что адсорбир. монослой представляет собой неидеальный двумерный газ, однако полимолекулярное покрытие поверхности адсорбента в данной модели не рассматривается. И, наконец, потенциальная модель А. базируется на представлении о потенц. поле поверхности твёрдого тела, в к-ром адсорбир. газ сжат вблизи поверхности и разрежен в наружных слоях. Эти различные в своей основе модели могут приводить к математически идентичным выражениям, хорошо согласующимся с эксперим. данными. Полуэмпирич. теории, основанные
на рассмотренных моделях, не позволяют достаточно строго интерпретировать эксперим. данные, т. к. пока не удаётся учитывать энергетич. неоднородность поверхности, связанную с разл. природой центров А. Осн. термодинамич. ур-нием, описывающим А., является ур-ние Гиббса:
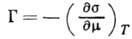
где
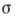 - поверхностное натяжение на границе раздела,
- поверхностное натяжение на границе раздела, 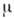 - химический потенциал адсорбата. Ур-ние Гиббса можно использовать в качестве исходного для вывода ур-ний А. при разл. условиях. К ним, в первую очередь, относятся ур-ния изотерм А., представляющие собой зависимость кол-ва адсорбир. вещества от давления р (или концентрации) адсорбата при пост. темп-ре.
- химический потенциал адсорбата. Ур-ние Гиббса можно использовать в качестве исходного для вывода ур-ний А. при разл. условиях. К ним, в первую очередь, относятся ур-ния изотерм А., представляющие собой зависимость кол-ва адсорбир. вещества от давления р (или концентрации) адсорбата при пост. темп-ре.Теория Ленгмюра позволяет вывести ур-ние одной из наиб, простых изотерм А., справедливое при строгой энергетич. однородности поверхности адсорбента, а также при отсутствии на поверхности латерального взаимодействия:
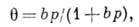
где b - константа, зависящая от темп-ры и характера взаимодействия адсорбат - адсорбент. Типичный вид изотермы Ленгмюра представлен кривой I на рис. 1. При низких значениях р, когда
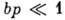 и
и 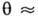
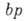 , изотерма Ленгмюра описывает А. в т. н. области Генри (см. Генри закон).
, изотерма Ленгмюра описывает А. в т. н. области Генри (см. Генри закон).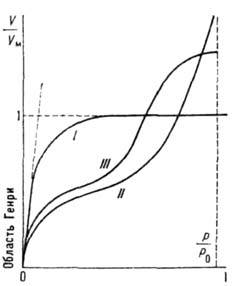
Рис. 1. Наиболее часто встречающиеся изотермы адсорбции.
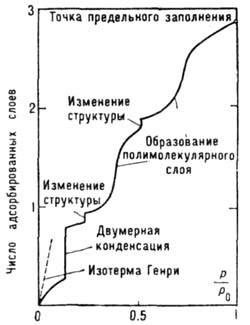
Рис. 2. Обобщённая изотерма адсорбции (изотерма Холси).
На рис. 1 это отражено прямолинейностью нач. участка изотермы, совпадающего с прямой пунктирной линией. Теория Ленгмюра применима к описанию монослойной физ. А. и хемосорбции, но лишь для огранич. числа систем. Узкая область применимости теории Ленгмюра объясняется, по-видимому, энергетич. неоднородностью поверхности, а также латеральным взаимодействием. Последний фактор в наиб. простом приближении можно учесть путём введения в ур-ние Ленгмюра вместо константы b константу
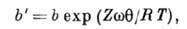
где Z - координационное число центров А. на поверхности,
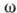 - энергия латерального взаимодействия двух адсорбир. молекул.
- энергия латерального взаимодействия двух адсорбир. молекул.Модель Ленгмюра имеет достаточно общий характер и служит основой для построения более развитых теорий, особенно хорошо описывающих хемосорбцию. Так, если допустить, что распределение числа центров А по энергии носит экспоненц. характер, можно получить ур-ние изотермы Фрейндлиха, в большей степени, чем ур-ние Ленгмюра, применимое для описания процессов не только хемосорбции, но и физ. А.:
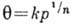 , где n>1 и k - постоянные. Использование экспериментально полученной линейной зависимости теплоты А. от степени заполнения поверхности при ср. значениях последней приводит к изотерме Шлыгина - Фрумкина для хемосорбции:
, где n>1 и k - постоянные. Использование экспериментально полученной линейной зависимости теплоты А. от степени заполнения поверхности при ср. значениях последней приводит к изотерме Шлыгина - Фрумкина для хемосорбции: 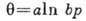 ( а и b - константы).
( а и b - константы).Вид наиб. часто встречающихся эксперим. типов изотерм (кривые II и III на рис. 1) можно объяснить только на основе теорий, учитывающих полимолекулярность физ. А, Из них наиб. часто применяемой является теория Брунауэра - Эмметта - Теллера (БЭТ), основанная на локализованной модели А. с центрами в виде двумерных ячеек и отсутствии латерального взаимодействия. Её гл. положения - непостоянство толщины адсорбц. слоя на разных участках поверхности и равенство теплот А. теплоте конденсации адсорбата во всех слоях, начиная со второго. Ур-ние изотермы БЭТ имеет вид
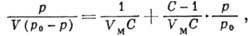
где
 - давление насыщенного пара адсорбата, V- объём адсорбир. вещества, VM - ёмкость монослоя,
- давление насыщенного пара адсорбата, V- объём адсорбир. вещества, VM - ёмкость монослоя,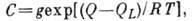
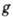 - статистич. множитель (обычно
- статистич. множитель (обычно 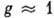 ),
), 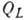 - теплота конденсации адсорбата. При малых относит. давлениях
- теплота конденсации адсорбата. При малых относит. давлениях 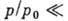 1 ур-ние БЭТ переходит в ур-ние Ленгмюра
1 ур-ние БЭТ переходит в ур-ние Ленгмюра 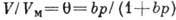
(где
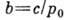 ). Существуют модификации теории, применимые к пористым адсорбентам в области капиллярной конденсации (кривая III). Теория БЭТ не учитывает латерального взаимодействия, что является её существ. недостатком, наряду с предположением о равенстве теплоты А. теплоте конденсации уже во втором слое. На основе теории БЭТ получено большое число эмпирич. ур-ний, позволяющих описать вид изотерм в нек-рых конкретных адсорбц. системах, но не. являющихся универсальными.
). Существуют модификации теории, применимые к пористым адсорбентам в области капиллярной конденсации (кривая III). Теория БЭТ не учитывает латерального взаимодействия, что является её существ. недостатком, наряду с предположением о равенстве теплоты А. теплоте конденсации уже во втором слое. На основе теории БЭТ получено большое число эмпирич. ур-ний, позволяющих описать вид изотерм в нек-рых конкретных адсорбц. системах, но не. являющихся универсальными.В потенц. теории А. (т. н. теория Поляни) полагается, что А. протекает под действием не зависящего от темп-ры потенциала
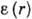 , численно равного работе, совершаемой адсорбц. силами при переносе молекулы адсорбата из газовой фазы в данную точку, находящуюся на расстоянии r от поверхности адсорбента; при этом свободная энергия адсорбата увеличивается за счёт сжатия последнего и
, численно равного работе, совершаемой адсорбц. силами при переносе молекулы адсорбата из газовой фазы в данную точку, находящуюся на расстоянии r от поверхности адсорбента; при этом свободная энергия адсорбата увеличивается за счёт сжатия последнего и 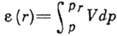 .
.На основании потенц. модели можно для каждой адсорбц. системы построить характеристическую кривую
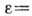
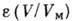 [в полимолекулярной области
[в полимолекулярной области 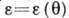 и характеристическая кривая может описывать энергетич. неоднородность поверхности]; с её помощью можно рассчитывать изотермы А. при разл. темп-рах, а также по изотерме А. одного адсорбата рассчитать изотерму А. для другого.
и характеристическая кривая может описывать энергетич. неоднородность поверхности]; с её помощью можно рассчитывать изотермы А. при разл. темп-рах, а также по изотерме А. одного адсорбата рассчитать изотерму А. для другого.В теории, основанной на модели двумерной фазы, вводят ур-ния состояния двумерного газа, аналогичные соответствующим ур-ниям состояния газа в трёхмерном пространстве, напр. ур-ние состояния типа ур-ния Менделеева - Клапейрона:
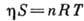 , где
, где 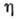 - давление в двумерном слое, S - площадь поверхности, занятой адсорбатом, п - число молей адсорбир. вещества. На практике используют обычно одно из ур-ний состояния реального газа и с его помощью выводят ур-ния, описывающие изотермы, аналогичные изотерме I на рис. 1. Кроме того, теория А. на основе модели двумерной фазы находится в определ. соответствии с потенц. моделью, если ф-ция
- давление в двумерном слое, S - площадь поверхности, занятой адсорбатом, п - число молей адсорбир. вещества. На практике используют обычно одно из ур-ний состояния реального газа и с его помощью выводят ур-ния, описывающие изотермы, аналогичные изотерме I на рис. 1. Кроме того, теория А. на основе модели двумерной фазы находится в определ. соответствии с потенц. моделью, если ф-ция 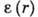 имеет вид прямоуг. потенц. ямы.
имеет вид прямоуг. потенц. ямы.Плавная форма изотерм А., по-видимому, является следствием энергетич. неоднородности поверхности. В то же время адсорбаты и их комплексы с адсорбентами могут претерпевать на поверхности фазовые переходы, проявляющиеся лишь в условиях строгой энергетич. однородности поверхности в форме ступенек и изломов на эксперим. изотермах. Обобщённая (модельная) изотерма Холси (рис. 2) отражает разл.
типы фазовых переходов, соответствующих как субмонослойной области, так и области полимолекулярной А. Возможность всех подобных типов переходов была подтверждена экспериментально.
Все перечисленные модели и теории относятся, в первую очередь, к А. на твёрдых адсорбентах из газовой фазы, однако с небольшими изменениями они пригодны и для описания А. из растворов.
Особое место занимает А. растворённого вещества на границе раздела жидкость - воздух. Согласно ур-нию Гиббса, величина А. таких веществ
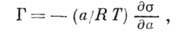
где а- активность растворённого вещества. Соединения, для к-рых
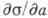 <0, т. е. Г>0, наз. поверхностно-активными веществами (ПАВ); они характеризуются, как правило, полярностью более низкой, чем полярность растворителя. А. ПАВ носит обычно характер монослойной физ. А. и хорошо описывается теорией Ленгмюра.
<0, т. е. Г>0, наз. поверхностно-активными веществами (ПАВ); они характеризуются, как правило, полярностью более низкой, чем полярность растворителя. А. ПАВ носит обычно характер монослойной физ. А. и хорошо описывается теорией Ленгмюра.Помимо изотерм А., на практике часто пользуются изостерами А., выражающими зависимость между равновесным давлением и темп-рой А. для определ. кол-ва адсорбир. вещества. При помощи изостер, полученных методом термодесорбции, осуществляют обычно вычисление теплот А., к-рые можно определять также методом калориметрии. Для изучения А. в настоящее время применяется также разнообразный арсенал совр. методов исследования вещества. Для определения кол-ва адсорбир. вещества, числа адсорбц. центров и величины адсорбир. поверхности используют машинные методы анализа эксперим. изотерм, а также гравиметрич. и радиоизотопный методы и высокотемпературную газовую хроматографию.
Поверхность адсорбентов исследуют с помощью методов рентгеновского структурного анализа и электронографии, оже-спектроскопии, мёссбауэровской спектроскопии, рентгеновской и рентгеноэлектронной спектроскопии, масс-спектроскопии, а также электронной микроскопии, мюонного и позитронного методов. Для изучения молекул в адсорбир. состоянии используют флэш-десорбцию (см. Десорбция), все виды оптической и резонансной спектроскопии, дифракцию медленных электронов, магн. методы, методы электронного или ионного проекторов, а также всевозможные электро-хим. методы.
А. играет важную роль во мн. природных процессах, в первую очередь в обогащении почв и образовании вторичных рудных месторождений. Явление А. широко используется для разделения сложных газовых и жидких смесей (хроматография), а также смесей электролитов (ионообменная хроматография), в процессах крашения и протравливания, флотации и стабилизации дисперсных систем. А. имеет важное значение в гетерогенно-каталитич. хим. реакциях, во мн. биол. процессах - одним словом везде, где существ. роль играют поверхностные явления.
Лит.: Трепнел Б., Хемосорбция, пер. с англ., М., 1958; Грег С., Синг К., Адсорбция, удельная поверхность, пористость, пер. с англ., 2 изд., М., 1984; Межфазовая граница газ - твердое тело, пер. с англ., М., 1970; Основные проблемы теории физической адсорбции, М., 1970; Адсорбция растворенных веществ, К., 1977; Адамсон А., Физическая химия поверхностей, пер. с англ., М., 1979. А. X. Кероглу.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
