- КИСЛОРОД
- КИСЛОРОД
-
(Oxygenium), O,- хим. элемент VI группы периодич. системы элементов, ат. номер 8, ат. масса 15,9994 а. е. м. Природный К. состоит из трёх стабильных изотопов: 16 О(99,762%),17 О (0,038%) и 18O (0,200%). Ядра атомов 16 О содержат 8 протонов и 8 нейтронов и обладают особой устойчивостью; они являются самыми распространёнными ядрами земной коры. Тетраэдрич. атомный радиус К. (при координац. числе 4) равен 0,066 нм, октаэдрич. (координац. число 6) 0,074 нм, радиус иона О 2- 0,136 нм. Электронная конфигурация внеш. оболочки 2s2p4. Энергии последоват. ионизации 13,618, 35,117 и 54,90 эВ. Сродство к электрону 1,467 эВ. Значение электроотрицательности 3,50.
К. существует в виде двух простых веществ: собственно К. с молекулой O2 и озона O3, к-рый образуется, напр., в электрич. разрядах в атмосфере. Молекулы О 2 достаточно устойчивы, энергия их диссоциации 493,6 кДж/моль (при 0 К), межъядерное расстояние 0,120735 нм. Энергия ионизации молекулы O2 12,2 эВ, сродство к электрону 0,94 эВ. В молекуле О 3 межъядерное расстояние 0,12717 нм, валентный угол О-О-О 116,78°. Озон неустойчив и легко распадается О,
 O2+O.
O2+O.
К. O2 - бесцветный газ без запаха и вкуса; озон О 3 обладает синей окраской и имеет резкий запах. К. О 2 при О °С имеет теплоёмкость с р=29,27 Дж/мольК, cV=20,5 Дж/мольК, t кип = -192,98°С, t пл = -218,7°С. Твёрдый К. при темп-ре ниже -249,3 °С имеет ромбич. кристаллич. решётку (
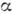 -О, синие кристаллы), при темп-ре -249,3 °С переходит в
-О, синие кристаллы), при темп-ре -249,3 °С переходит в 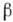 -О с ромбоэдрич. кристаллич. решёткой. При темп-ре выше -229,4 °С существует
-О с ромбоэдрич. кристаллич. решёткой. При темп-ре выше -229,4 °С существует 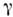 -О с кубич. кристаллич. решёткой. Плотность газообразного К. 1,42897 кг/м 3 (при О °С и нормальном давлении), жидкого - 1,1321 кг/дм 3 (при t кип), твёрдого -1,46 кг/дм 3 (при -252,7 °С). Кри-тич. темп-pa - 118,84 °С, критич. давление 4,97 МПа, теплота испарения 6,82 кДж/моль, теплота плавления 0,443 кДж/моль. При 0 °С теплопроводность 24мВт/м-К, диэлектрич. проницаемость 1,000547, вязкость 18,9 мкПа-с. Парамагнитен, магн. восприимчивость
-О с кубич. кристаллич. решёткой. Плотность газообразного К. 1,42897 кг/м 3 (при О °С и нормальном давлении), жидкого - 1,1321 кг/дм 3 (при t кип), твёрдого -1,46 кг/дм 3 (при -252,7 °С). Кри-тич. темп-pa - 118,84 °С, критич. давление 4,97 МПа, теплота испарения 6,82 кДж/моль, теплота плавления 0,443 кДж/моль. При 0 °С теплопроводность 24мВт/м-К, диэлектрич. проницаемость 1,000547, вязкость 18,9 мкПа-с. Парамагнитен, магн. восприимчивость 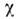 = 107,8-10-9 (при 20°С). Растворимость К. в 1м 3 воды при нормальном давлении 0,031 м 3 (20 °С) и 0,049 м 3(0°С).
= 107,8-10-9 (при 20°С). Растворимость К. в 1м 3 воды при нормальном давлении 0,031 м 3 (20 °С) и 0,049 м 3(0°С).
В соединениях К. проявляет степень окисления -2, реже -1. Обладает высокой реакц. способностью (хим. активность О 3 выше, чем O2) и образует соединения почти со всеми хим. элементами. Бинарные соединения, в к-рых атомы К. не связаны между собой, наз. оксидами (CaO, SO2 и др.). Соединения, содержащие группировку О-О, наз. пероксидами (напр., пероксид водорода Н 2O2). Хим. реакции с участием К. (реакции окисления) обычно сопровождаются выделением большого кол-ва тепла.
К. используют для интенсификации разл. процессов (напр., при выплавке стали). Жидкий К. служит окислителем ракетного топлива, его применяют при изготовлении взрывчатых веществ. Озон ядовит, способен сильно раздражать глаза и дыхат. пути. Находит применение искусств.
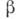 - -радиоактивный нуклид 19O (
- -радиоактивный нуклид 19O ( =27 с).
=27 с).
Лит.: Кислород. Справочник, под ред. Д. Л. Глизманенко, ч. 1-2, М., 1967. С. С. Бердоносов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
