- РАВНОРАСПРЕДЕЛЕНИЯ ЗАКОН
- РАВНОРАСПРЕДЕЛЕНИЯ ЗАКОН
-
закон классич. статистической физики, утверждающий, что для статистич. системы в состоянии термодинамич. равновесия на каждую трансляц. и вращат. степень свободы приходится в среднем кинетич. энергия kT/2, а на каждую колебат. степень свободы — в среднем энергия kT (где Т -абс. темп-ра системы, k — Больцмана постоянная). Р. з.— приближённый закон; он нарушается в тех случаях, когда становятся существенными квант. эффекты (а в случае колебат. степеней свободы — также и ангармоничность колебаний). Р. з. позволяет легко оценить предельные значения теплоёмкостей многоатомных газов и тв. тел при высоких темп-рах.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- РАВНОРАСПРЕДЕЛЕНИЯ ЗАКОН
-
- утверждение, согласно к-рому в классич. равновесной статистич. системе ср. кинетич. энергия, приходящаяся на каждую трансляционную, вращательную и колебательную степени свободы, равна q/2 (q = kT), ср. потенц. энергия, приходящаяся на каждое гармонич. колебание в системе,- тоже q/2. Т. о., на каждую колебат. степень свободы в ср. приходится энергия q - в 2 раза больше, чем на каждую трансляц. и вращат. степени свободы. Р. з. является прямым следствием статистич. вириала теоремы:
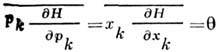
(чертой сверху обозначено усреднение с помощью классич. канонического распределения Гиббса )и того, что Гамильтона функция системы Я представляет квад-ратич. форму по обобщённым импульсам р k для любого типа движения в нерелятивистской системе и квадратич. форму по обобщённым координатам х k для каждого происходящего в ней гармонич. колебания.
Р. з. ограничен областью применимости классич. приближения: условие невырожденности газа
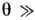 qвыр ==
qвыр ==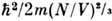 (см. Больцмана распределе ние), где V- объём системы, содержащий N молекул массой т, обеспечивает применимость Р. з. по отношению к трансляц. движению, условия
(см. Больцмана распределе ние), где V- объём системы, содержащий N молекул массой т, обеспечивает применимость Р. з. по отношению к трансляц. движению, условия 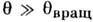 = =
= =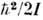 и
и 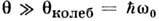 - по отношению к вращению молекул газа и колебат. движениям в них (I - момент инерции, w0 - частота собств. колебаний). Численные значения этих характерных темп-р заметно отличаются друг от друга по порядкам величин. Напр., для молекул, входящих в состав воздуха,
- по отношению к вращению молекул газа и колебат. движениям в них (I - момент инерции, w0 - частота собств. колебаний). Численные значения этих характерных темп-р заметно отличаются друг от друга по порядкам величин. Напр., для молекул, входящих в состав воздуха,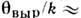
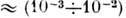 К,
К,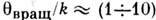 К,
К,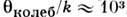 К,
К,и поэтому при комнатной темп-ре ( Т
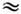 300 К) трансляц. и вращат. движения невырождены и подчиняются Р. з., тогда как колебания как бы выключены ("заморожены") и практически не дают своего вклада в термодинамич. характеристики системы. Р. з. эффективно применим в случаях, когда система может быть аппроксимирована идеальной (т. е. учёт взаимодействия частиц даёт малые поправки к равновесным термодинампч. характеристикам газа), а, кроме того, внутр. движения в молекулах (напр., вращения и колебания) независимы друг от друга и от поступат. перемещений (трансляций) молекул.
300 К) трансляц. и вращат. движения невырождены и подчиняются Р. з., тогда как колебания как бы выключены ("заморожены") и практически не дают своего вклада в термодинамич. характеристики системы. Р. з. эффективно применим в случаях, когда система может быть аппроксимирована идеальной (т. е. учёт взаимодействия частиц даёт малые поправки к равновесным термодинампч. характеристикам газа), а, кроме того, внутр. движения в молекулах (напр., вращения и колебания) независимы друг от друга и от поступат. перемещений (трансляций) молекул.Для расчёта внутр. энергии
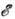 и теплоёмкости при пост. объёме
и теплоёмкости при пост. объёме 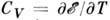 газа, состоящего из n-атомных молекул (общее число молекул - N), следует подсчитать число независимых степеней свободы, приходящихся на одну молекулу: 3 трансляционные, 3 вращательные, 3n- 6 колебательных (в линейных молекулах 2 вращательные и 3n- 5 колебательных), и воспользоваться Р. з. Тогда
газа, состоящего из n-атомных молекул (общее число молекул - N), следует подсчитать число независимых степеней свободы, приходящихся на одну молекулу: 3 трансляционные, 3 вращательные, 3n- 6 колебательных (в линейных молекулах 2 вращательные и 3n- 5 колебательных), и воспользоваться Р. з. Тогда 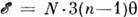 [для газа из линейных молекул
[для газа из линейных молекул 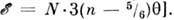 Для простых твёрдых тел, рассматриваемых в гармонич. приближении (см. Динамика кристаллической решётки), из Р. з. при темп-pax выше Дебая температуры следует Дю-лонга и Пти закон
Для простых твёрдых тел, рассматриваемых в гармонич. приближении (см. Динамика кристаллической решётки), из Р. з. при темп-pax выше Дебая температуры следует Дю-лонга и Пти закон 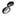 = N·3qили для молярной теплоёмкости кристалла, С моп = 3R (R- универсальная газовая постоянная). Для равновесного излучения Р. з. приводит к Рэлея- Джинса закону излучения, справедливому в области низких частот
= N·3qили для молярной теплоёмкости кристалла, С моп = 3R (R- универсальная газовая постоянная). Для равновесного излучения Р. з. приводит к Рэлея- Джинса закону излучения, справедливому в области низких частот 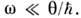
Лит.: Квасников И. А., Термодинамика и статистическая физика, М., 1991. И. А. Квасников.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.
