- АТОМ
- АТОМ
-
(от греч. atomos — неделимый), часть в-ва микроскопич. размеров и массы (микрочастица), наименьшая часть хим. элемента, являющаяся носителем его св-в. Каждому хим. элементу соответствует определ. род А., обозначаемый хим. символом. А. существуют в свободном (в газе) и в связ. состояниях. Связываясь друг с другом непосредственно или в составе молекул, А. образуют жидкие и тв. тела. Все хим. и физ. св-ва А. определяются особенностями его строения.Общая характеристика строения атома. А. состоит из тяжёлого ядра, обладающего положит. электрич. зарядом, и окружающих его лёгких ч-ц — эл-нов с отрицат. электрич. зарядами, образующих электронные оболочки А. Размеры А. в целом определяются размерами его электронной оболочки и велики по сравнению с размерами ядра А. (линейные размеры А.=10-8см, ядра =10-12—10-13 см). Электронные оболочки не имеют строго определ. границ, и размеры А. в б. или м. степени зависят от способов их определения (см. АТОМНЫЕ РАДИУСЫ).Заряд ядра — осн. хар-ка А., обусловливающая его принадлежность к определ. элементу; он явл. целым кратным элементарного электрич. заряда е, равного по абс. значению заряду эл-на — е, т. е. равен +eZ, где Z — ат. номер (порядковый номер элемента в периодической системе элементов). А.— электрически нейтр. система: ядро с зарядом +eZ удерживает Z эл-нов с общим зарядом -eZ. А., потерявший один или неск. эл-нов, наз. положит. ионом, его заряд равен +ek, где k — кратность ионизации. А., присоединивший эл-ны, явл. отрицат. ионом. Иногда под термином А. понимают как нейтр. А., так и его ионы. Для отличия положит. и отрицат. ионов от нейтр. А. к хим. символу элемента добавляют индекс, определяющий кратность ионизации (напр., О+ , O8+, О2-). Совокупность нейтр. А. и ионов др. элементов с тем же числом эл-нов образует и з о э л е к т р о н н ы й ряд (напр., водородоподобный ряд Н, Не+ , Li'2+, . . .). Кратность заряда ядра А. элем. заряду объясняется его строением: в его состав входит Z протонов, имеющих заряд +е, а также нейтр. ч-цы — нейтроны. Масса А. возрастает с увеличением Z и обусловлена в основном массой ядра, пропорциональной массовому числу А — общему числу протонов и нейтронов в ядре. Масса эл-на (>0,91•10-27 г) значительно меньше (примерно в 1840 раз) массы протона или нейтрона (> 1,67•10-24 г), поэтому их вклад в ат. массу незначителен .А. одного элемента могут иметь разные массовые числа (число протонов одинаково, а число нейтронов различно); такие разновидности А. одного и того же элемента наз. изотопами. Различие массы ядер почти не сказывается на хим. и физ. св-вах изотопов одного элемента. Наибольшие отличия (изотопич. эффекты) наблюдаются у изотопов водорода вследствие большой разницы в массах обычного лёгкого водорода (протия, A=1), дейтерия (А=2) и трития (А=3).Точные значения масс А. определяются методами масс-спектроскопии. Измерения показали, что масса А. меньше суммы масс ядра и всех эл-нов на величину, наз. дефектом масс: Dm = W/c2, где W—энергия связи А. Для тяжёлых А. Dm — порядка массы эл-на, для лёгких =10-4 массы эл-на.Энергия атома и её квантование. Благодаря малым размерам и большой массе ядро А. можно приближённо считать точечным и покоящимся в центре масс А. (т. к. общий центр масс ядра и эл-нов находится вблизи ядра, а скорость движения ядра относительно центра масс мала по сравнению со скоростями эл-нов). А. можно рассматривать как систему N эл-нов, движущихся вокруг неподвижного притягивающего центра. Полная внутр. энергия такой системы ? равна сумме кинетич. энергий Т всех эл-нов и потенц. энергии U притяжения их ядром и отталкивания друг от друга. В простейшем случае А. водорода один эл-н с зарядом -е движется вокруг ядра с зарядом +е. Кинетич. энергия эл-на в таком А. равна:T=1/2mv2 = r2/2m, (1) где т — масса, v — скорость, р=mv — импульс эл-на; потенц. энергия А.U=U(r)=- е2/r (2) зависит только от расстояния r эл-на от ядра. Графически ф-ция U(r) изображается кривой (рис. 1, а), неограниченно убывающей (возрастающей по абс. значению) при уменьшении r, т. е. при приближении эл-на к ядру. Значение U(r) при г®? принято за нуль. Если полная энергия ?=Т+U<0, то движение эл-на явл. связанным: оно ограничено в пр-ве значением r=rмакс , при к-ром T=0, ?=U(rмакс). При g=T+U>0 движение эл-на явл. свободным — он может уйти на бесконечность с энергией ?=Т=1/2mv2, т. <е. при ?>0 А. водорода становится положит. ионом Н+ .А. явл. квант. системой, т. е. подчиняется квантово-механич. законам (см. КВАНТОВАЯ МЕХАНИКА); его осн. хар-ка — полная внутр. энергия ?, к-рая может принимать лишь одно из значений дискр. ряда:?1, ?2, ?3, ... (?1Промежуточными значениями ? А. обладать не может. Каждому из «дозволенных» значений ? соответствует одно или неск. стационарных (неизменных во времени) квант. состояний А. Энергия А. может изменяться только скачкообразно — путём квантового перехода А. из одного стационарного состояния в другое.Графически возможные значения энергии А. изображают в виде схемы уровней энергии — горизонт. прямых, проведённых на расстояниях, соответствующих разностям ‘дозволенных’ энергий (рис. 1, б). Самый нижний уровень ?1, отвечающий минимальной возможной энергии, наз. основным, все остальные (?n>?1, , n=2, 3, . . .) — возбуждёнными, т. к. для перехода на них А. необходимо возбудить — сообщить ему извне энергию ?n-?1.Квантование энергии А. явл. следствием волн. св-в эл-нов (см. КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ). Согласно квант. механике, движению микрочастицы с импульсом р соответствует длина волны l=h/p, для эл-на в А. l=10-8см, т. е. порядка линейных размеров А. Связанное движение эл-на в А. (?<0) схоже со стоячей волной, его следует рассматривать как сложный колебат. процесс, а не как движение матер. точки по траектории. Для стоячей волны в огранич. объёме возможны лишь определ. значения l; для модели атома Бора, согласно к-рой эл-н движется в А. по определ. орбитам, возможными будут те круговые орбиты, на к-рых укладывается целое число l Определ. значениям l соответствуют определ. значения р и ?.Свободное движение эл-на, оторванного от А., подобно распространению бегущей волны в неогранич. объёме, для к-рой возможны любые значения l; его энергия не квантуется и имеет непрерывный энергетический спектр. Такая непрерывная последовательность энергий характерна для ионизованного А., т. е. при ?>0. Значение ??=0 соответствует границе ионизации А., а разность ??-?1 равна энергии ионизации из осн. состояния ?ион (для водорода ?ион=13,6 эВ).Орбитальный и спиновый моменты электрона. Наряду с энергией движение эл-на в А. вокруг ядра (орбит. движение) характеризуется орбит. моментом импульса Мl; с ним связан орбитальный магн. момент эл-на в А. Эл-н обладает также собств. моментом импульса Ms — спином и связанным с ним спиновым магн. моментом. Вз-ствие спинового и орбитального моментов (спин-орбитальное взаимодействие) влияет на орбитальное движение эл-на в А.Распределение электронной плотности в атоме. Состояние эл-на в А. можно характеризовать распределением в пр-ве его электрич. заряда — распределением электронной плотности. При этом ат. эл-ны рассматриваются как ‘размазанные’ в пр-ве и образующие вокруг ядра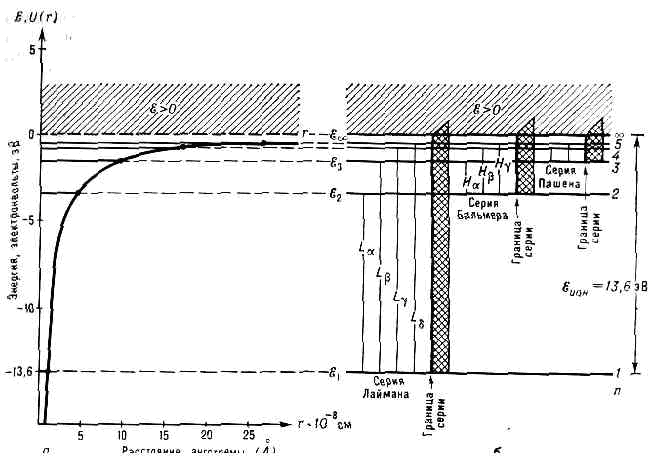 Рис. 1. Зависимость энергии ? атома водорода от расстояния r: а — возможные значения полной внутр. энергии ?1, ?2, ?3,... (горизонт. линии) и график потенц. энергии (жирная кривая; точками показаны значения rмакс при ?=?1, ?2, ?3,...); б — схема уровней энергии (горизонт. линии) и оптич. переходов (вертик. линии). Заштрихованная область (8 >0) соответствует ионизов. атому водорода.
Рис. 1. Зависимость энергии ? атома водорода от расстояния r: а — возможные значения полной внутр. энергии ?1, ?2, ?3,... (горизонт. линии) и график потенц. энергии (жирная кривая; точками показаны значения rмакс при ?=?1, ?2, ?3,...); б — схема уровней энергии (горизонт. линии) и оптич. переходов (вертик. линии). Заштрихованная область (8 >0) соответствует ионизов. атому водорода. Рис.2. Возможные состояния атома водорода при значениях n=1,2,3. Графически показаны ориентации орбитального и спинового моментов.электронное облако. Такая модель правильнее отражает состояние эл-на в А., чем модель атома Бора. Наибольшая электронная плотность в А. водорода соответствует осн. состоянию, когда электронное облако концентрируется на наиб. близком от ядра расстоянии; для возбуждённых состояний она распределяется на всё больших расстояниях от ядра. В сложных А. эл-ны группируются в электронные оболочки, окружающие ядро на разл. расстояниях и характеризующиеся определ. значениями электронной плотности. Слабее всего связаны с ядром эл-ны самой внеш. оболочки, к-рые определяют размеры А. в целом.Квантовые состояния атома водорода. Методами квант. механики можно получить точную и полную хар-ку состояний эл-на в одноэлектронном А. (А. водорода и водородоподобных А.), в то время как задача о многоэлектронных А. может быть решена лишь приближённо. Энергия одноэлектронного А. (без учёта спина эл-на) равна:
Рис.2. Возможные состояния атома водорода при значениях n=1,2,3. Графически показаны ориентации орбитального и спинового моментов.электронное облако. Такая модель правильнее отражает состояние эл-на в А., чем модель атома Бора. Наибольшая электронная плотность в А. водорода соответствует осн. состоянию, когда электронное облако концентрируется на наиб. близком от ядра расстоянии; для возбуждённых состояний она распределяется на всё больших расстояниях от ядра. В сложных А. эл-ны группируются в электронные оболочки, окружающие ядро на разл. расстояниях и характеризующиеся определ. значениями электронной плотности. Слабее всего связаны с ядром эл-ны самой внеш. оболочки, к-рые определяют размеры А. в целом.Квантовые состояния атома водорода. Методами квант. механики можно получить точную и полную хар-ку состояний эл-на в одноэлектронном А. (А. водорода и водородоподобных А.), в то время как задача о многоэлектронных А. может быть решена лишь приближённо. Энергия одноэлектронного А. (без учёта спина эл-на) равна: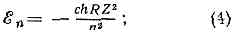 целое число n=1, 2, 3, . . . определяет возможные уровни энергии и наз. главным квантовым числом; R—Ридберга постоянная (hcR=13,6 эВ). Согласно (4), с ростом n уровни сближаются и при n®? сходятся к границе . ионизации ??=0 (рис. 1,6); уровни с n>5 не показаны, схема уровней дана для А. водорода (Z=1), для водородоподобных А. масштаб энергий возрастает в Z2 раз.Можно показать, что водородоподобный А. с энергией, определяемой выражением (4), имеет ср. радиус a=a0n2/Z, (5) где постоянная а0=0,529•10-8 см=0,529 ? — т. н. боровский радиус, определяющий размеры А. водорода в осн. состоянии (n=1, Z=1); им часто пользуются как ед. длины в ат. физике.Согласно квант. механике, состояние А. водорода полностью определяется дискр. значениями четырёх физ. величин: энергии 8, орбит. момента Мl, проекции Mlz орбит. момента на нек-рое произвольное направление z, проекции Мsz спинового момента Мs на z. Возможные значения этих величин, в свою очередь, определяются соответствующими квантовыми числами:? — главным квантовым числом n=1, 2, 3, ... (по ф-ле (4)); Мl— орбитальным (или азимутальным) квантовым числом l=0, 1, 2, . . ., n-1:M2l=l(l+1)h2;Mlz — магнитным орбитальным квантовым числом ml=l, l-1, . . ., -l :Mlz=hml;Мsz — магнитным спиновым числом ms=±1/2: Msz=msh.Значения квант. чисел n, l, ml, ms полностью определяют состояние эл-на в А. водорода. Энергия А. водорода зависит только от га, и уровню с заданным n соответствует неск. состояний, отличающихся значениями l, ml и ms. Состояния с заданными значениями n и l принято обозначать как is, 2s, 2p, 3s и т. д., где цифры указывают значения n, а буквы s, p, d, f (и дальше по лат. алфавиту) — соотв. значения l=0, 1, 2, 3, ... При заданных n и l число разл. состояний равно 2(2l+1)—числу комбинаций значений ml и ms. Общее число разл. состояний с заданным га равно:
целое число n=1, 2, 3, . . . определяет возможные уровни энергии и наз. главным квантовым числом; R—Ридберга постоянная (hcR=13,6 эВ). Согласно (4), с ростом n уровни сближаются и при n®? сходятся к границе . ионизации ??=0 (рис. 1,6); уровни с n>5 не показаны, схема уровней дана для А. водорода (Z=1), для водородоподобных А. масштаб энергий возрастает в Z2 раз.Можно показать, что водородоподобный А. с энергией, определяемой выражением (4), имеет ср. радиус a=a0n2/Z, (5) где постоянная а0=0,529•10-8 см=0,529 ? — т. н. боровский радиус, определяющий размеры А. водорода в осн. состоянии (n=1, Z=1); им часто пользуются как ед. длины в ат. физике.Согласно квант. механике, состояние А. водорода полностью определяется дискр. значениями четырёх физ. величин: энергии 8, орбит. момента Мl, проекции Mlz орбит. момента на нек-рое произвольное направление z, проекции Мsz спинового момента Мs на z. Возможные значения этих величин, в свою очередь, определяются соответствующими квантовыми числами:? — главным квантовым числом n=1, 2, 3, ... (по ф-ле (4)); Мl— орбитальным (или азимутальным) квантовым числом l=0, 1, 2, . . ., n-1:M2l=l(l+1)h2;Mlz — магнитным орбитальным квантовым числом ml=l, l-1, . . ., -l :Mlz=hml;Мsz — магнитным спиновым числом ms=±1/2: Msz=msh.Значения квант. чисел n, l, ml, ms полностью определяют состояние эл-на в А. водорода. Энергия А. водорода зависит только от га, и уровню с заданным n соответствует неск. состояний, отличающихся значениями l, ml и ms. Состояния с заданными значениями n и l принято обозначать как is, 2s, 2p, 3s и т. д., где цифры указывают значения n, а буквы s, p, d, f (и дальше по лат. алфавиту) — соотв. значения l=0, 1, 2, 3, ... При заданных n и l число разл. состояний равно 2(2l+1)—числу комбинаций значений ml и ms. Общее число разл. состояний с заданным га равно: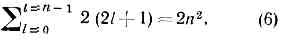 т. <е. уровням, определяемым n=1, 2, 3, . . ., соответствуют 2, 8, 18, . . ., 2n2 разл. квант. состояний (рис. 2). Уровень, к-рому соответствует лишь одно квант. состояние, наз. невырожденным. Если уровню соответствует g?2 квант. состояний, то он наз. вырожденным, а число g — кратностью или степенью вырождения. Уровни А. водорода — вырожденные, их степень вырождения g=2n2. Спин-орбитальное вз-ствие приводит к расщеплению уровней энергии с n?2 на близко расположенные друг к другу подуровни тонкой структуры, т. е. к частичному снятию вырождения.Для разл. квант. состояний А. водорода получается разл. распределение электронной плотности, к-рое зависит от n, l и ml.[s]АТОМ5.bmp, АТОМ6.bmp[/s]Рис. 3. Распределение электронной плотности для состояний атома водорода с n=1,2,3; m=me. Так, при l=0 (s-состояния) электронная плотность отлична от нуля в центре и не зависит от направления (сферически симметрична), а для ; остальных состояний она равна нулю в центре и зависит от направления (рис. 3). Квант. состояния эл-на в водородоподобных А. также характеризуются четырьмя квант. числами, картина распределения электронной плотности аналогична приведённой на рис. 3, однако (согласно (5)) масштабы уменьшаются в Z раз.Электронные оболочки сложных атомов. Все А., кроме А. водорода и водородоподобных А., имеют в своём составе взаимодействующие друг с другом одинаковые ч-цы — эл-ны. Вследствие взаимного отталкивания эл-нов в А. существенно уменьшается их прочность связи с ядром. Напр., энергия отрыва эл-на у иона Не + —54,4 эВ, в нейтральном атоме Не для любого из двух эл-нов она равна 24,6 эВ. Для более тяжёлых А. связи внеш. эл-нов с ядром ещё более ослабевают. Чрезвычайно важную роль в сложных А. играет св-во неразличимости эл-нов (см. ТОЖДЕСТВЕННОСТИ ПРИНЦИП) и тот факт, что эл-ны, обладающие спином 1/2, подчиняются Паули принципу, согласно к-рому в каждом квант. состоянии не может находиться более одного эл-на. Это приводит к образованию в сложном А. электронных оболочек, заполняющихся строго определ. образом.Для многоэлектронного А. имеет смысл говорить только о квант. состояниях А. в целом. Однако приближённо можно рассматривать квант. состояния отд. эл-нов и характеризовать каждый из них совокупностью четырёх квант. чисел: n, l, ml; и ms. При этом энергия эл-на оказывается зависящей не только от n, но и от l; от ml и ms она по-прежнему не зависит. Эл-ны с определёнными n и l имеют одинаковую энергию и образуют электронную оболочку, их наз. э к в и в а л е н т н ы м и э л е к т р о н а м и. Такие эл-ны и образованные ими оболочки с заданными n и l обозначают символами ns, пр, nd, nf, ... и говорят, напр., о 28-электронах, Зр-оболочке и т. д.Заполнение электронных оболочек и слоев. В силу принципа Паули, любые два эл-на в А. должны находиться в разл. квант. состояниях и, следовательно, отличаться хотя бы одним из четырёх квант. чисел. Для эквивалентных эл-нов n и l одинаковы, поэтому должны быть различны пары значений ml и ms. Число таких пар (степень вырождения уровня энергии) g=2(2l+1), для l=0, 1, 2, 3, ... оно равно соотв. 2, 6, 10, 14, . . ., g определяет число эл-нов в сложном А., полностью заполняющих данную оболочку. Т. о., s-, р-, d-, f-,... оболочки заполняются соотв. 2, 6, 10, 14, . . . эл-нами независимо от значения п. Эл-ны с данным n образуют электронный слой, состоящий из оболочек с l=0, 1, 2, . . ., n-1 и заполняемый 2n2 эл-нами. Для n=1, 2, 3, 4, ... слои обозначаются символами К, L, М, N, ... При полном заполнении оболочек и слоев получаем:
т. <е. уровням, определяемым n=1, 2, 3, . . ., соответствуют 2, 8, 18, . . ., 2n2 разл. квант. состояний (рис. 2). Уровень, к-рому соответствует лишь одно квант. состояние, наз. невырожденным. Если уровню соответствует g?2 квант. состояний, то он наз. вырожденным, а число g — кратностью или степенью вырождения. Уровни А. водорода — вырожденные, их степень вырождения g=2n2. Спин-орбитальное вз-ствие приводит к расщеплению уровней энергии с n?2 на близко расположенные друг к другу подуровни тонкой структуры, т. е. к частичному снятию вырождения.Для разл. квант. состояний А. водорода получается разл. распределение электронной плотности, к-рое зависит от n, l и ml.[s]АТОМ5.bmp, АТОМ6.bmp[/s]Рис. 3. Распределение электронной плотности для состояний атома водорода с n=1,2,3; m=me. Так, при l=0 (s-состояния) электронная плотность отлична от нуля в центре и не зависит от направления (сферически симметрична), а для ; остальных состояний она равна нулю в центре и зависит от направления (рис. 3). Квант. состояния эл-на в водородоподобных А. также характеризуются четырьмя квант. числами, картина распределения электронной плотности аналогична приведённой на рис. 3, однако (согласно (5)) масштабы уменьшаются в Z раз.Электронные оболочки сложных атомов. Все А., кроме А. водорода и водородоподобных А., имеют в своём составе взаимодействующие друг с другом одинаковые ч-цы — эл-ны. Вследствие взаимного отталкивания эл-нов в А. существенно уменьшается их прочность связи с ядром. Напр., энергия отрыва эл-на у иона Не + —54,4 эВ, в нейтральном атоме Не для любого из двух эл-нов она равна 24,6 эВ. Для более тяжёлых А. связи внеш. эл-нов с ядром ещё более ослабевают. Чрезвычайно важную роль в сложных А. играет св-во неразличимости эл-нов (см. ТОЖДЕСТВЕННОСТИ ПРИНЦИП) и тот факт, что эл-ны, обладающие спином 1/2, подчиняются Паули принципу, согласно к-рому в каждом квант. состоянии не может находиться более одного эл-на. Это приводит к образованию в сложном А. электронных оболочек, заполняющихся строго определ. образом.Для многоэлектронного А. имеет смысл говорить только о квант. состояниях А. в целом. Однако приближённо можно рассматривать квант. состояния отд. эл-нов и характеризовать каждый из них совокупностью четырёх квант. чисел: n, l, ml; и ms. При этом энергия эл-на оказывается зависящей не только от n, но и от l; от ml и ms она по-прежнему не зависит. Эл-ны с определёнными n и l имеют одинаковую энергию и образуют электронную оболочку, их наз. э к в и в а л е н т н ы м и э л е к т р о н а м и. Такие эл-ны и образованные ими оболочки с заданными n и l обозначают символами ns, пр, nd, nf, ... и говорят, напр., о 28-электронах, Зр-оболочке и т. д.Заполнение электронных оболочек и слоев. В силу принципа Паули, любые два эл-на в А. должны находиться в разл. квант. состояниях и, следовательно, отличаться хотя бы одним из четырёх квант. чисел. Для эквивалентных эл-нов n и l одинаковы, поэтому должны быть различны пары значений ml и ms. Число таких пар (степень вырождения уровня энергии) g=2(2l+1), для l=0, 1, 2, 3, ... оно равно соотв. 2, 6, 10, 14, . . ., g определяет число эл-нов в сложном А., полностью заполняющих данную оболочку. Т. о., s-, р-, d-, f-,... оболочки заполняются соотв. 2, 6, 10, 14, . . . эл-нами независимо от значения п. Эл-ны с данным n образуют электронный слой, состоящий из оболочек с l=0, 1, 2, . . ., n-1 и заполняемый 2n2 эл-нами. Для n=1, 2, 3, 4, ... слои обозначаются символами К, L, М, N, ... При полном заполнении оболочек и слоев получаем: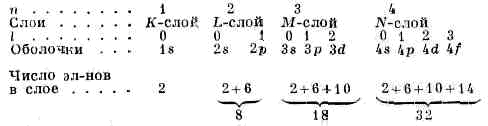 Наиболее близко к ядру расположен K-слой, затем L-слой, М-слой, N-слой, . . . Прочность связи эл-на в А. уменьшается с увеличением n, а при заданном n — с увеличением l. Чем слабее связан эл-н с ядром, тем выше лежит его уровень энергии в соответствующей оболочке (рис. 4).Электронные конфигурации сложных атомов. Порядок заполнения электронных оболочек в сложном А. определяет его электронные конфигурации, т. е. распределения эл-нов по оболочкам, для ионов и нейтр. А. данного элемента. Напр., для азота (Z=7) получаются электронные конфигурации
Наиболее близко к ядру расположен K-слой, затем L-слой, М-слой, N-слой, . . . Прочность связи эл-на в А. уменьшается с увеличением n, а при заданном n — с увеличением l. Чем слабее связан эл-н с ядром, тем выше лежит его уровень энергии в соответствующей оболочке (рис. 4).Электронные конфигурации сложных атомов. Порядок заполнения электронных оболочек в сложном А. определяет его электронные конфигурации, т. е. распределения эл-нов по оболочкам, для ионов и нейтр. А. данного элемента. Напр., для азота (Z=7) получаются электронные конфигурации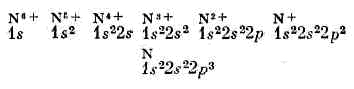 (число эл-нов в данной оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и у ионов азота, имеют нейтр. А. элементов в периодич. системе, обладающие тем же числом эл-нов: Н, Не, Li, Be, В, С (Z=1, 2, 3, 4,5, 6). Периодичность в св-вах элементов определяется сходством внеш. электронных оболочек А. Напр., нейтр. атомы Р, АS, Sb, Bi (Z=15, 33, 51, 83) имеют по
(число эл-нов в данной оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и у ионов азота, имеют нейтр. А. элементов в периодич. системе, обладающие тем же числом эл-нов: Н, Не, Li, Be, В, С (Z=1, 2, 3, 4,5, 6). Периодичность в св-вах элементов определяется сходством внеш. электронных оболочек А. Напр., нейтр. атомы Р, АS, Sb, Bi (Z=15, 33, 51, 83) имеют по Рис. 4. Схема последовательного заполнения уровней энергии эл-нами в сложном атоме. Справа указано число эл-нов, заполняющих отд. оболочки. три р-электрона во внеш. электронной оболочке, подобно атому N, и схожи с ним по хим. и многим физ. св-вам.При рассмотрении заполнения электронных оболочек необходимо учитывать, что, начиная с n=4, порядок заполнения оболочек нарушается: эл-ны с меньшим l, но большим n связаны прочнее, чем эл-ны с большим l, но меньшим n, напр. эл-ны 4s связаны прочнее, чем эл-ны 3d (рис. 4). При заполнении оболочек 3d, 4d, 5d получаются группы переходных элементов, при заполнении 4f и 5f-оболочек — соотв. лантаноиды и актиноиды. Числа, стоящие на рисунке справа у скобок, равны числу эл-нов в полностью заполненной оболочке и определяют число элементов в периоде системы элементов. Каждый период завершают А. инертных газов с внеш. оболочками типа np6 (n=2, 3, 4, 5, 6) для Ne, Ar, Kr, Xe, Rn (Z=10, 18, 36, 54, 86).Сложный А. характеризуется т. н. нормальной электронной конфигурацией, соответствующей наиб. прочной связи всех эл-нов в А., и возбуждёнными электронными конфигурациями, когда один или неск. эл-нов связаны более слабо — находятся на возбуждённых уровнях энергии. Напр., для А. Не наряду с нормальной электронной конфигурацией 1s2 возможны возбуждённые: 1s2s, 1s2p и др. (возбуждён один эл-н), 2s2, 2s2p и др. (возбуждены оба эл-на). Определённой электронной конфигурации соответствует один уровень энергии А. в целом, если электронные оболочки целиком заполнены (напр., норм. конфигурация атома Ne 1s22s2 2p6), и ряд уровней энергии, если имеются частично заполненные оболочки (напр., норм. конфигурация атома N 1s22s22p:3, для к-рой оболочка 2р заполнена наполовину). При наличии частично заполненных d- и f-оболочек число уровней энергии сильно возрастает и схема уровней энергии А. получается очень сложной. Осн. уровнем энергии А. явл. самый нижний уровень нормальной электронной конфигурации.Квантовые переходы в атоме. При квант. переходах А. с более высокого уровня энергии ?i на более низкий ?k он отдаёт энергию ?i-?k, при обратном переходе получает её. Важнейшая хар-ка квант. перехода — вероятность перехода, определяющая число переходов в 1 с.При квант. переходах с излучением А. поглощает (переход ?k®?i) или испускает (переход ?i®?k) эл.-магн. излучение, напр. видимый свет, УФ, ИК, СВЧ (микроволновое) излучение. Эл.-магн. энергия поглощается и испускается А. в виде кванта света — фотона, характеризуемого определ. частотой v, согласно соотношению:?i-?k=hv (7)(hv — энергия фотона), представляющему собой закон сохранения энергии для микропроцессов, связанных с излучением.А. в осн. состоянии может только поглощать фотоны, а в возбуждённом — как поглощать, так и испускать их. Свободный А. в осн. состоянии может существовать неограниченно долго; продолжительность пребывания его в возбуждённом состоянии — время жизни на возбуждённом уровне энергии — ограничена: А. спонтанно (самопроизвольно) частично или полностью теряет энергию возбуждения, испуская фотон и переходя на более низкий уровень энергии. Время жизни возбуждённого А. тем меньше, чем больше вероятность спонтанного перехода (для возбуждённого атома Н оно =10-8 с).Совокупность частот возможных переходов с излучением определяет оптич. спектр А.: совокупность частот переходов с нижних уровней на верхние — спектр поглощения, с верхних на нижние — спектр испускания. Каждому такому переходу соответствует определ. спектральная линия. Для атома Н, согласно (4) и (7), получаем совокупность спектр. линий с частотами
Рис. 4. Схема последовательного заполнения уровней энергии эл-нами в сложном атоме. Справа указано число эл-нов, заполняющих отд. оболочки. три р-электрона во внеш. электронной оболочке, подобно атому N, и схожи с ним по хим. и многим физ. св-вам.При рассмотрении заполнения электронных оболочек необходимо учитывать, что, начиная с n=4, порядок заполнения оболочек нарушается: эл-ны с меньшим l, но большим n связаны прочнее, чем эл-ны с большим l, но меньшим n, напр. эл-ны 4s связаны прочнее, чем эл-ны 3d (рис. 4). При заполнении оболочек 3d, 4d, 5d получаются группы переходных элементов, при заполнении 4f и 5f-оболочек — соотв. лантаноиды и актиноиды. Числа, стоящие на рисунке справа у скобок, равны числу эл-нов в полностью заполненной оболочке и определяют число элементов в периоде системы элементов. Каждый период завершают А. инертных газов с внеш. оболочками типа np6 (n=2, 3, 4, 5, 6) для Ne, Ar, Kr, Xe, Rn (Z=10, 18, 36, 54, 86).Сложный А. характеризуется т. н. нормальной электронной конфигурацией, соответствующей наиб. прочной связи всех эл-нов в А., и возбуждёнными электронными конфигурациями, когда один или неск. эл-нов связаны более слабо — находятся на возбуждённых уровнях энергии. Напр., для А. Не наряду с нормальной электронной конфигурацией 1s2 возможны возбуждённые: 1s2s, 1s2p и др. (возбуждён один эл-н), 2s2, 2s2p и др. (возбуждены оба эл-на). Определённой электронной конфигурации соответствует один уровень энергии А. в целом, если электронные оболочки целиком заполнены (напр., норм. конфигурация атома Ne 1s22s2 2p6), и ряд уровней энергии, если имеются частично заполненные оболочки (напр., норм. конфигурация атома N 1s22s22p:3, для к-рой оболочка 2р заполнена наполовину). При наличии частично заполненных d- и f-оболочек число уровней энергии сильно возрастает и схема уровней энергии А. получается очень сложной. Осн. уровнем энергии А. явл. самый нижний уровень нормальной электронной конфигурации.Квантовые переходы в атоме. При квант. переходах А. с более высокого уровня энергии ?i на более низкий ?k он отдаёт энергию ?i-?k, при обратном переходе получает её. Важнейшая хар-ка квант. перехода — вероятность перехода, определяющая число переходов в 1 с.При квант. переходах с излучением А. поглощает (переход ?k®?i) или испускает (переход ?i®?k) эл.-магн. излучение, напр. видимый свет, УФ, ИК, СВЧ (микроволновое) излучение. Эл.-магн. энергия поглощается и испускается А. в виде кванта света — фотона, характеризуемого определ. частотой v, согласно соотношению:?i-?k=hv (7)(hv — энергия фотона), представляющему собой закон сохранения энергии для микропроцессов, связанных с излучением.А. в осн. состоянии может только поглощать фотоны, а в возбуждённом — как поглощать, так и испускать их. Свободный А. в осн. состоянии может существовать неограниченно долго; продолжительность пребывания его в возбуждённом состоянии — время жизни на возбуждённом уровне энергии — ограничена: А. спонтанно (самопроизвольно) частично или полностью теряет энергию возбуждения, испуская фотон и переходя на более низкий уровень энергии. Время жизни возбуждённого А. тем меньше, чем больше вероятность спонтанного перехода (для возбуждённого атома Н оно =10-8 с).Совокупность частот возможных переходов с излучением определяет оптич. спектр А.: совокупность частот переходов с нижних уровней на верхние — спектр поглощения, с верхних на нижние — спектр испускания. Каждому такому переходу соответствует определ. спектральная линия. Для атома Н, согласно (4) и (7), получаем совокупность спектр. линий с частотами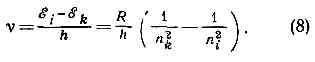 Согласно (8), линии в спектре А. водорода группируются в спектральные серии. При nk=1 и ni=2, 3, 4, ... получается серия Лаймана (линии La, Lb, Lg, . . .), при nk=2 и ni=3, 4, 5, . . .— серия Бальмера (линии Нa, Hb, Нg, . . .), при nk=3 и ni=4, 5, . . .— серия Пашена и т. д. (рис. 1, б). Для А. других элементов в соответствии с более сложной схемой уровней энергии получаются и более сложные атомные спектры.При квант. переходах без излучения А. получает или отдаёт энергию при вз-ствиях с другими ч-цами, с к-рыми он сталкивается (напр., в газах) или длительно связан (в молекулах, жидкостях и тв. телах). В атомарных газах в промежутках между столкновениями можно считать А. свободным; во время столкновения (удара) он может перейти на другой уровень энергии (неупругое столкновение, при упругом столкновении изменяется лишь кинетич. энергия А., а внутренняя остаётся неизменной). Столкновение свободного А. с быстро движущимся эл-ном — возбуждение А. электронным ударом — один из методов определения уровней энергии А. (см. СТОЛКНОВЕНИЯ АТОМНЫЕ).Химические и физические свойства атома. Большинство св-в А. определяется строением и хар-ками его внеш. электронных оболочек, в к-рых эл-ны связаны сравнительно слабо (энергия связи от неск. эВ до неск. десятков эВ). Строение внутр. оболочек А., эл-ны к-рых связаны гораздо прочнее (энергии связи =102—104 эВ), проявляется лишь при вз-ствиях А. с быстрыми ч-цами и фотонами высоких энергий. Такие вз-ствия определяют рентгеновские спектры А. и рассеяние ч-ц на А. (см. ДИФРАКЦИЯ МИКРОЧАСТИЦ). Масса А. определяет механич. св-ва А. как целого — его импульс, кинетич. энергию. От механических и связанных с ними магн. и электрич. моментов ядра А. зависят нек-рые тонкие физ. эффекты (ядерный магнитный резонанс, ядерный квадрупольный резонанс, сверхтонкая структура).Эл-ны во внеш. оболочках А. легко подвергаются внеш. воздействиям. При сближении А. возникают сильные электростатич.. вз-ствия (включая т. н. обменное взаимодействие), к-рые могут приводить к образованию молекул. В хим. связи участвуют эл-ны внеш. оболочек.Более слабые электростатич. вз-ствия двух А. проявляются в их взаимной поляризуемости — смещении эл-нов относительно ядер. Возникают поляризац. силы притяжения между А. (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ). Поляризуемость А. происходит и во внеш. электрич. полях; в результате уровни энергии смещаются и, что особенно важно, вырожденные уровни энергии расщепляются (см. ШТАРКА ЭФФЕКТ). А. может поляризоваться и под действием электрич. поля световой волны; поляризуемость зависит от частоты, что обусловливает зависимость от неё и показателя преломления (см. ДИСПЕРСИЯ СВЕТА), связанного с поляризуемостью А. Тесная связь оптических характеристик А. с его электрич. св-вами особенно ярко проявляется в его оптических спектрах.Внеш. эл-нами определяются и магн. св-ва А. В А. с полностью заполненными электронными оболочками магн. момент, как и полный механич. момент, равен нулю. Магн. моменты А. с частично заполненными внеш. оболочками, как правило, не равны нулю; такие А. явл. парамагнитными (см. ПАРАМАГНЕТИЗМ). Во внеш. магн. поле все уровни А., у к-рых магн. момент не равен нулю, расщепляются (см. ЗЕЕМАНА ЭФФЕКТ). Все А. обладают диамагнетизмом, к-рый обусловлен возникновением у них магн. момента под действием внеш. магн. поля (т. н. индуцированного момента).При последоват. ионизации А., т. е. при отрыве его эл-нов, начиная с самых внешних в порядке увеличения прочности их связи, соотв. изменяются все св-ва А., определяемые его внеш. электронной оболочкой: уменьшается способность А. поляризоваться в электрич. поле, увеличиваются расстояния между уровнями энергии и частоты оптич. переходов между ними, что приводит к смещению спектров в сторону более коротких длин волн. Ряд св-в обнаруживает периодичность: сходными оказываются св-ва ионов с аналогичными внеш. эл-нами, напр. N4+ и N3+ (один и два эл-на 2s) обнаруживают сходство с N6+ и N7+ (один и два эл-на 1s). Это относится к хар-кам и относит. расположению уровней энергии, к оптич. спектрам, к магн. моментам А. и т. д. Наиболее резкое изменение св-в происходит при удалении последнего эл-на из внеш. незаполненной оболочки. Такие ионы (напр., N5+ с электронной конфигурацией 1s2) наиб. устойчивы, и их полные механич. и магн. моменты равны нулю.Св-ва А., находящегося в связ. состоянии (напр., входящего в состав молекул), отличаются от св-в свободного А. Наибольшие изменения претерпевают св-ва А., определяемые самыми внеш. эл-нами, принимающими участие в присоединении данного А. к другому. Вместе с тем св-ва, определяемые эл-нами внутр. оболочек, могут практически не измениться, как это имеет место для рент. спектров. Нек-рые св-ва А. могут испытывать сравнительно небольшие изменения, по к-рым можно получить информацию о хар-ре вз-ствий связанных А. Примером может служить расщепление уровней энергии А. в кристаллах и комплексных соединениях, к-рое происходит под действием электрич. полей, создаваемых окружающими ионами (см. КРИСТАЛЛИЧЕСКОЕ ПОЛЕ).
Согласно (8), линии в спектре А. водорода группируются в спектральные серии. При nk=1 и ni=2, 3, 4, ... получается серия Лаймана (линии La, Lb, Lg, . . .), при nk=2 и ni=3, 4, 5, . . .— серия Бальмера (линии Нa, Hb, Нg, . . .), при nk=3 и ni=4, 5, . . .— серия Пашена и т. д. (рис. 1, б). Для А. других элементов в соответствии с более сложной схемой уровней энергии получаются и более сложные атомные спектры.При квант. переходах без излучения А. получает или отдаёт энергию при вз-ствиях с другими ч-цами, с к-рыми он сталкивается (напр., в газах) или длительно связан (в молекулах, жидкостях и тв. телах). В атомарных газах в промежутках между столкновениями можно считать А. свободным; во время столкновения (удара) он может перейти на другой уровень энергии (неупругое столкновение, при упругом столкновении изменяется лишь кинетич. энергия А., а внутренняя остаётся неизменной). Столкновение свободного А. с быстро движущимся эл-ном — возбуждение А. электронным ударом — один из методов определения уровней энергии А. (см. СТОЛКНОВЕНИЯ АТОМНЫЕ).Химические и физические свойства атома. Большинство св-в А. определяется строением и хар-ками его внеш. электронных оболочек, в к-рых эл-ны связаны сравнительно слабо (энергия связи от неск. эВ до неск. десятков эВ). Строение внутр. оболочек А., эл-ны к-рых связаны гораздо прочнее (энергии связи =102—104 эВ), проявляется лишь при вз-ствиях А. с быстрыми ч-цами и фотонами высоких энергий. Такие вз-ствия определяют рентгеновские спектры А. и рассеяние ч-ц на А. (см. ДИФРАКЦИЯ МИКРОЧАСТИЦ). Масса А. определяет механич. св-ва А. как целого — его импульс, кинетич. энергию. От механических и связанных с ними магн. и электрич. моментов ядра А. зависят нек-рые тонкие физ. эффекты (ядерный магнитный резонанс, ядерный квадрупольный резонанс, сверхтонкая структура).Эл-ны во внеш. оболочках А. легко подвергаются внеш. воздействиям. При сближении А. возникают сильные электростатич.. вз-ствия (включая т. н. обменное взаимодействие), к-рые могут приводить к образованию молекул. В хим. связи участвуют эл-ны внеш. оболочек.Более слабые электростатич. вз-ствия двух А. проявляются в их взаимной поляризуемости — смещении эл-нов относительно ядер. Возникают поляризац. силы притяжения между А. (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ). Поляризуемость А. происходит и во внеш. электрич. полях; в результате уровни энергии смещаются и, что особенно важно, вырожденные уровни энергии расщепляются (см. ШТАРКА ЭФФЕКТ). А. может поляризоваться и под действием электрич. поля световой волны; поляризуемость зависит от частоты, что обусловливает зависимость от неё и показателя преломления (см. ДИСПЕРСИЯ СВЕТА), связанного с поляризуемостью А. Тесная связь оптических характеристик А. с его электрич. св-вами особенно ярко проявляется в его оптических спектрах.Внеш. эл-нами определяются и магн. св-ва А. В А. с полностью заполненными электронными оболочками магн. момент, как и полный механич. момент, равен нулю. Магн. моменты А. с частично заполненными внеш. оболочками, как правило, не равны нулю; такие А. явл. парамагнитными (см. ПАРАМАГНЕТИЗМ). Во внеш. магн. поле все уровни А., у к-рых магн. момент не равен нулю, расщепляются (см. ЗЕЕМАНА ЭФФЕКТ). Все А. обладают диамагнетизмом, к-рый обусловлен возникновением у них магн. момента под действием внеш. магн. поля (т. н. индуцированного момента).При последоват. ионизации А., т. е. при отрыве его эл-нов, начиная с самых внешних в порядке увеличения прочности их связи, соотв. изменяются все св-ва А., определяемые его внеш. электронной оболочкой: уменьшается способность А. поляризоваться в электрич. поле, увеличиваются расстояния между уровнями энергии и частоты оптич. переходов между ними, что приводит к смещению спектров в сторону более коротких длин волн. Ряд св-в обнаруживает периодичность: сходными оказываются св-ва ионов с аналогичными внеш. эл-нами, напр. N4+ и N3+ (один и два эл-на 2s) обнаруживают сходство с N6+ и N7+ (один и два эл-на 1s). Это относится к хар-кам и относит. расположению уровней энергии, к оптич. спектрам, к магн. моментам А. и т. д. Наиболее резкое изменение св-в происходит при удалении последнего эл-на из внеш. незаполненной оболочки. Такие ионы (напр., N5+ с электронной конфигурацией 1s2) наиб. устойчивы, и их полные механич. и магн. моменты равны нулю.Св-ва А., находящегося в связ. состоянии (напр., входящего в состав молекул), отличаются от св-в свободного А. Наибольшие изменения претерпевают св-ва А., определяемые самыми внеш. эл-нами, принимающими участие в присоединении данного А. к другому. Вместе с тем св-ва, определяемые эл-нами внутр. оболочек, могут практически не измениться, как это имеет место для рент. спектров. Нек-рые св-ва А. могут испытывать сравнительно небольшие изменения, по к-рым можно получить информацию о хар-ре вз-ствий связанных А. Примером может служить расщепление уровней энергии А. в кристаллах и комплексных соединениях, к-рое происходит под действием электрич. полей, создаваемых окружающими ионами (см. КРИСТАЛЛИЧЕСКОЕ ПОЛЕ).Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
.
атом — атом, а … Русский орфографический словарь
АТОМ — (греч. atomos, от а отриц. част., и tome, tomos отдел, отрезок). Бесконечно малая неделимая частица, совокупность которых составляет всякое физическое тело. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. АТОМ греч … Словарь иностранных слов русского языка
атом — а м. atome m. 1. Мельчайшая неделимая частица вещества. Атомы не могут быть вечны. Кантемир О природе. Ампер полагает, что каждая неделимая частица материи (атом) содержит неотъемлемое от нея количество электричества. ОЗ 1848 56 8 240. Да будет… … Исторический словарь галлицизмов русского языка
АТОМ — АТОМ, мельчайшая частица вещества, которая может вступать в химические реакции. У каждого вещества имеется характерный только для него набор атомов. В свое время считалось, что атом неделим, однако, он состоит из положительно заряженного ЯДРА,… … Научно-технический энциклопедический словарь
АТОМ — (от греч. atomos – неделимое) мельчайшие составные частицы материи, из которых состоит все сущее, в т. ч. и душа, образованная из тончайших атомов (Левкипп, Демокрит, Эпикур). Атомы вечны, они не возникают и не исчезают, пре • бывая в постоянном… … Философская энциклопедия
Атом — Атом ♦ Atome Этимологически атом – неделимая частица, или частица, подвластная только умозрительному делению; неделимый элемент (atomos) материи. В этом смысле понимают атом Демокрит и Эпикур. Современным ученым хорошо известно, что это… … Философский словарь Спонвиля
АТОМ — (от греч. atomos неделимый) мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное Ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные … Большой Энциклопедический словарь
АТОМ — муж., греч. неделимое; вещество в крайних пределах делимости своей, незримая пылинка, из каких будто бы составлены все тела, всякое вещество, как бы из песчинок. | Неизмеримая, бесконечно малая пылинка, ничтожное количество. | У химиков слово… … Толковый словарь Даля
атом — См … Словарь синонимов
АТОМ — (от греч. atomos неделимый). Слово А. применяется в современной науке в разных смыслах. В большинстве случаев А. называют предельное количество хим. элемента, дальнейшее дробление к рого ведет к потере индивидуальности элемента, т. е. к резкому… … Большая медицинская энциклопедия
атом — atom Atom частина речовини, яка є найменшим носієм хімічних властивостей певного хімічного елемента. Відомо стільки видів атомів, скільки є хімічних елементів та їх ізотопів. Електрично нейтральний, складається з ядра й електронів. Радіус атома… … Гірничий енциклопедичний словник
