- КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
- КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
-
раздел теор. физики, исследующий св-ва газов статистич. методами на основе представления об их мол, строении и определ. законе вз-ствия между молекулами. Обычно к К. т. г. относят лишь теорию неравновесных св-в газов, теория же их равновесных св-в — область статистической физики равновесных систем. Осн. объекты применения К. т. г.— газы, газовые смеси и плазма, однако теория последней выделилась в самостоят. область теор. физики.Молекулы в газах движутся почти свободно в промежутках между столкновениями, приводящими к резкому изменению их скоростей. Время столкновения значительно меньше ср. времени свободного пробега молекул газа между столкновениями, поэтому теория неравновесных процессов в газах значительно проще, чем в жидкостях или тв. телах. Наблюдаемые физ. хар-ки газа представляют собой результат действия всех его молекул. Для вычисления этих хар-к нужно знать распределение молекул газа по скоростям и пр-ву, занятому газом, т. е. знать функцию распределения f(v, r, t). Произведение f(v,r,t)dvdr определяет вероятное число молекул, находящихся в момент времени t в элементе объёма dr=dxdydz около точки r и обладающих скоростями в пределах dv=dvxdvydvz вблизи значения v. Плотность n числа ч-ц газа в точке r в момент t равна: n(r, t)=?f(v,r,t)dv. Осн. задача К. т. г.— определение явного вида ф-ции f(v, r, t), поскольку она позволяет вычислить ср. значения величин, характеризующих состояние газа, и процессы переноса энергии, импульса и числа ч-ц, к-рые могут в нём происходить. Напр., v (r, t)=1/n??v?f(v, r, t)dv — средняя (по абс. величине) скорость молекул газа, a v2= 1/n?v2f(v, r, t)dv — ср. квадрат их скорости.Для идеального однородного газа в состоянии статистич. равновесия ф-ция f представляет собой Максвелла распределение: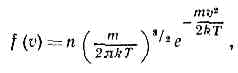 где т — масса молекулы. В этом случае
где т — масса молекулы. В этом случае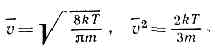 Передача энергии и импульса в газе происходит гл. обр. благодаря парным столкновениям молекул. Вероятное число парных столкновений молекул dv в ед. времени, находящихся в объёме dr и имеющих скорости в пределах dv1 и dv2 около значений скоростей v1 и v2, равно:dv=f(v1, r, t)Xf(v2, r, t)?v1-v2?sdWdv1dv2,где sdW — дифференциальное эфф. сечение сталкивающихся молекул в лаб. системе координат (так, s=d2cosq для модели молекул в виде упругих сфер с диаметром d, где q — угол между относит. скоростью v1-v2 и линией центров сталкивающихся молекул, т. е. линией, соединяющей центры молекул в момент их наибольшего сближения). Это выражение для числа столкновений основано на «гипотезе мол. хаоса», т. е. на предположении об отсутствии корреляции между скоростями сталкивающихся молекул, что справедливо для разреженных газов и газов ср. плотности.Ср. длину свободного пробега молекул I можно определить через ср. число столкновений в ед. времени; l — ср. расстояние, к-рое прошла бы молекула за ср. время между столкновениями, двигаясь со ср. скоростью v, т. е. l=v/n, где n=1/n?dv. Можно также определить l как ср. расстояние между двумя последоват. столкновениями. В этом случае сначала вычисляют пробег для молекул с данной скоростью, а затем его усредняют по всем скоростям молекул. Для газа с молекулами в виде упругих сфер по первому определению l=1/?2pd2n, а по второму определению l=0,667/pd2n , различие между ними невелико.Элем. теория явлений переноса основана на понятии ср. длины свободного пробега. Рассматривая перенос импульса, энергии, массы компонентов через единичную площадку в газе, можно соответственно получить значения коэфф. вязкости m, теплопроводности l и взаимной диффузии D12 двух компонентов (1 и 2) газовой смеси:
Передача энергии и импульса в газе происходит гл. обр. благодаря парным столкновениям молекул. Вероятное число парных столкновений молекул dv в ед. времени, находящихся в объёме dr и имеющих скорости в пределах dv1 и dv2 около значений скоростей v1 и v2, равно:dv=f(v1, r, t)Xf(v2, r, t)?v1-v2?sdWdv1dv2,где sdW — дифференциальное эфф. сечение сталкивающихся молекул в лаб. системе координат (так, s=d2cosq для модели молекул в виде упругих сфер с диаметром d, где q — угол между относит. скоростью v1-v2 и линией центров сталкивающихся молекул, т. е. линией, соединяющей центры молекул в момент их наибольшего сближения). Это выражение для числа столкновений основано на «гипотезе мол. хаоса», т. е. на предположении об отсутствии корреляции между скоростями сталкивающихся молекул, что справедливо для разреженных газов и газов ср. плотности.Ср. длину свободного пробега молекул I можно определить через ср. число столкновений в ед. времени; l — ср. расстояние, к-рое прошла бы молекула за ср. время между столкновениями, двигаясь со ср. скоростью v, т. е. l=v/n, где n=1/n?dv. Можно также определить l как ср. расстояние между двумя последоват. столкновениями. В этом случае сначала вычисляют пробег для молекул с данной скоростью, а затем его усредняют по всем скоростям молекул. Для газа с молекулами в виде упругих сфер по первому определению l=1/?2pd2n, а по второму определению l=0,667/pd2n , различие между ними невелико.Элем. теория явлений переноса основана на понятии ср. длины свободного пробега. Рассматривая перенос импульса, энергии, массы компонентов через единичную площадку в газе, можно соответственно получить значения коэфф. вязкости m, теплопроводности l и взаимной диффузии D12 двух компонентов (1 и 2) газовой смеси: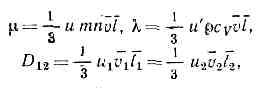 где с у — теплоёмкость при пост. объёме, r=mn — плотность газа, u, u', u2 — численные коэффициенты порядка единицы, для вычисления к-рых нужна более точная теория.Последовательная К. т. г. основана на решении кинетического уравнения Больцмана для ф-ции f, к-рое получается из баланса числа молекул в элементе фазового объёма dvdr с учётом приведённого выше выражения для вероятного числа столкновений. При помощи кинетич. ур-ния Больцмана можно решить все осн. задачи К. т. г., т. е. получить ур-ния переноса импульса, энергии и числа ч-ц (Навье — Стокса уравнения, ур-ния теплопроводности и диффузии) и вычислить входящие в них кинетические коэффициенты m, l, D12.Ближе к реальности модель, в к-рой молекулы рассматриваются как центры сил с потенциалом, зависящим от расстояния между ними. При этом дифференциальное эфф. сечение вз-ствия (для случая классич. механики) выражается через параметры столкновения b и e: sdW=bdbde, где b — прицельное расстояние, e — азимутальный угол линии центров. Для потенциала вз-ствия принимают обычно ф-ции простого вида, напр. const/rn (где n — нек-рая постоянная) или комбинацию подобных членов с разл. коэфф., к-рые учитывают притяжение молекул на больших расстояниях и отталкивание на малых. Для квант. газов выражение для эфф. сечения получают на основе квант. механики, учитывая при этом влияние эффектов симметрии на вероятность столкновения (см. КИНЕТИЧЕСКОЕ УРАВНЕНИЕ БОЛЬЦМАНА). Методы решения кинетич. ур-ния были разработаны англ. учёным С. Чепменом и швед. учёным Ц. Энскогом.К. т. г. позволяет исследовать:1) смеси газов, когда для каждого компонента нужно вводить свою ф-цию распределения и рассматривать столкновения между молекулами разл. компонентов;2) многоат. газы, когда нельзя рассматривать молекулу как матер. точку, а нужно учитывать её внутр. степени свободы (колебательные и вращательные);3) плотные газы, когда нужно учитывать корреляции между сталкивающимися молекулами или многократные столкновения;4) ионизов. газы (плазму), когда нельзя ограничиться учётом короткодействующих сил, а приходится также учитывать медленно убывающие с расстоянием кулоновские силы; это частично достигается введением самосогласованного поля;5) разреженные газы, когда длина свободного пробега ч-ц сравнима с размерами системы и нужно учитывать столкновения со стенками.
где с у — теплоёмкость при пост. объёме, r=mn — плотность газа, u, u', u2 — численные коэффициенты порядка единицы, для вычисления к-рых нужна более точная теория.Последовательная К. т. г. основана на решении кинетического уравнения Больцмана для ф-ции f, к-рое получается из баланса числа молекул в элементе фазового объёма dvdr с учётом приведённого выше выражения для вероятного числа столкновений. При помощи кинетич. ур-ния Больцмана можно решить все осн. задачи К. т. г., т. е. получить ур-ния переноса импульса, энергии и числа ч-ц (Навье — Стокса уравнения, ур-ния теплопроводности и диффузии) и вычислить входящие в них кинетические коэффициенты m, l, D12.Ближе к реальности модель, в к-рой молекулы рассматриваются как центры сил с потенциалом, зависящим от расстояния между ними. При этом дифференциальное эфф. сечение вз-ствия (для случая классич. механики) выражается через параметры столкновения b и e: sdW=bdbde, где b — прицельное расстояние, e — азимутальный угол линии центров. Для потенциала вз-ствия принимают обычно ф-ции простого вида, напр. const/rn (где n — нек-рая постоянная) или комбинацию подобных членов с разл. коэфф., к-рые учитывают притяжение молекул на больших расстояниях и отталкивание на малых. Для квант. газов выражение для эфф. сечения получают на основе квант. механики, учитывая при этом влияние эффектов симметрии на вероятность столкновения (см. КИНЕТИЧЕСКОЕ УРАВНЕНИЕ БОЛЬЦМАНА). Методы решения кинетич. ур-ния были разработаны англ. учёным С. Чепменом и швед. учёным Ц. Энскогом.К. т. г. позволяет исследовать:1) смеси газов, когда для каждого компонента нужно вводить свою ф-цию распределения и рассматривать столкновения между молекулами разл. компонентов;2) многоат. газы, когда нельзя рассматривать молекулу как матер. точку, а нужно учитывать её внутр. степени свободы (колебательные и вращательные);3) плотные газы, когда нужно учитывать корреляции между сталкивающимися молекулами или многократные столкновения;4) ионизов. газы (плазму), когда нельзя ограничиться учётом короткодействующих сил, а приходится также учитывать медленно убывающие с расстоянием кулоновские силы; это частично достигается введением самосогласованного поля;5) разреженные газы, когда длина свободного пробега ч-ц сравнима с размерами системы и нужно учитывать столкновения со стенками.
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
.
