- ПРОЛИН
(2-пирролидинкарбоновая к-та, Pro, P), мол. м. 115,13; бесцв. кристаллы; т. пл. L-, D- и D,L-П. соотв. 220-222, 215-220 и 205 °С (все изомеры плавятся с разл.); для L-П.
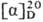 Ч85° (концентрация 4 г в 100 мл воды). П. хорошо раств. в воде (162,3 г в 100мл при 25 °С), ограничен-но-в этаноле (1,55 г в 100мл), ацетоне, хлороформе, не раств. в диэтиловом эфире; р К а при 25 °С 1,99 (СООН) и 10,6 (NH); р/ 6,3.
Ч85° (концентрация 4 г в 100 мл воды). П. хорошо раств. в воде (162,3 г в 100мл при 25 °С), ограничен-но-в этаноле (1,55 г в 100мл), ацетоне, хлороформе, не раств. в диэтиловом эфире; р К а при 25 °С 1,99 (СООН) и 10,6 (NH); р/ 6,3.
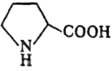
П.-единственная из кодируемых аминокислот, у к-рой a-аминогруппа - фрагмент гетероцикла. В отличие от др. аминокислот дает желтое, а не фиолетовое окрашивание в нингидриновой р-ции, с изатином дает синее окрашивание (характерная р-ция на П.). При окислении П. в организме животных образуются 3- и 4-гидроксипролины, остатки к-рых в больших кол-вах (особенно 4-гидроксипролина) содержатся в коллагене. Гидролиз пептидных связей, образованных П., осуществляется двумя ферментами-пролина-зой (связь с участием СООН П.) и пролидазой (с участием NH). Р-ции по атому N пространственно затруднены. Включение остатков П. в пептидную цепь обусловливает ее изгибы и потому его присутствие в белках препятствует образованию a-спиральной структуры.
L-П. заменимая аминокислота. Входит в состав практически всех белков. Особенно богаты L-П. коллаген, прола-мины (семена злаков) и эластин. В организме человека синтезируется из глутаминовой к-ты через ее полуальдегид (OCHCH2CH2CHNH2COOH), к-рый циклизуется в D1 -пир-ролин-5-карбоновую к-ту (отличается от П. двойной связью в положении 1); последняя восстанавливается в П.
Синтез П. может быть осуществлен циклизацией a, d-ди-хлорвалериановой к-ты. В спектре ПМР L-П. в D2O хим. сдвиги (в м. д.) 4,132 (положение 2 цикла), 2,35 и 2,075 (положение 3), 2,031 (положение 4), 3,41 и 3,354 (положение 5).
L-П. впервые выделен из казеина в 1901 Э. Фишером.
Мировое Произ-во 100 Т/ГОД (1982). В. В. Баев.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
