- МЫШЬЯКОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ,
содержат связь AsЧС. Иногда к М. с. относят все орг. соед., содержащие As, напрю эфиры мышьяковистой (RO)3As и мышьяковой (RO)3AsO к-т.
Известны производные As с кординационными числами 2-6, последние могут совпадать с валентностью или отличаться от неё.
Наиб. многочисленная группа М. с.-п р о и з в о д н ы е As c к о о р д и н а ц. ч и с л о м 3. К ней относятся органоарсины RnAsH3-n (n=1,3), тетраорганодиарсины R2As-AsR2, циклич. и линейные полиорганоарсины (RAs)n,> а также органоарсонистые и диорганоарсинистые к-ты и их производные RnAsX3-n (X=OH, SH, Hal, OR', NR'2 и др., n=1,2) (cм. Мышьяка кислоты органические).
Большинство М. с. этой группы-жидкости, полиорганоарсины и орг. к-ты As-твёрдые в-ва, CH3AsH2 и CF3AsH2- газы; соед., как правило, раств. в орг. р-рителях, ограниченно в воде; в отсутствие кислорода и влаги сравнительно устойчивы (низкой устойчивостью обладают органоарсениды Mg, B, Al, Ga, In). Нек-рые тетраорганодиарсины на воздухе воспламеняются.
Конфигурация молекул соед. трёхкоординац. As- тригон. пирамида, напр. для (CH3)3As длина связи C-As 0,1959 нм, угол CAsC 960 ; для CH3AsF, длины связей 0,192 нм (C-As), 0,174 нм (FЧAs), углы FAsF 96°, CAsF 95,5°. Значения m сравнительно невысокие, напр. для (CH3)3As 2,869.10-30 Кл . м, для CH3AsF2 9,606.10-30 Кл . м (исключение составляет Ph2AsCN, для к-рого m 13,976.10-30 Кл . м).
Спектры ИК и комбинац. рассеяния имеют характеристич. полосы (см -1): ~200 (AsЧI), ~280 (AsЧBr), 260-420 (AsЧCl), 590 b 40 (AsЧC), 670 b 20 (AsЧF), ~ 2100 (AsЧH). В масс-спектрах часто наблюдаются пики мол. ионов; характерны ион-диссоциативные процессы: разрыв связей AsЧС, миграция концевой части алкильного радикала (с отщеплением нейтральной частицы, напр. С 3 Н 6), атомов Н или F к As.
Органоарсины и мн. производные орг. к-т As устойчивы к нагреванию, напр. пиролиз (CH3)3As и (CF3)3As происходит при 350-400 °С, диспропорционирование галогенангидридов орг. к-т As-при 250-300°С.
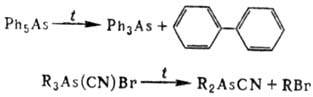
Основные св-ва соед. трехкоординац. As выражены слабее, чем соответствующих производных Р и N (напр., их соли с неорг. к-тами и адцукты с к-тами Льюиса неустойчивы); однако эти производные могут служить лигандами при комплексообразовании с солями переходных металлов. Соед. легко присоединяют О 2, S, Se, Hal2, образуя соответствующие производные четырех- и пятикоординац. As, алки-лируются алкилгалогенидами, напр.:
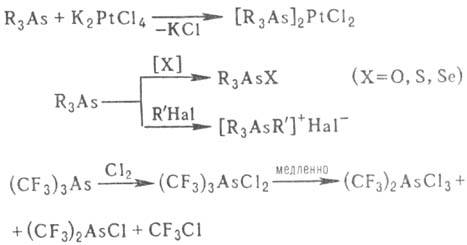
Органоарсины RAsH2 и R2AsH проявляют св-ва слабых к-т, с металлами (Li, Na, К, Са) или их алкилъными производными образуют органоарсениды.
В соед. трехкоординац. As связь AsЧX (X = Hal, OR, OAsR2, NR2) легко расщепляется при действии нуклео-филов, связь AsЧН-в электроф. и радикальных р-циях, напр.:
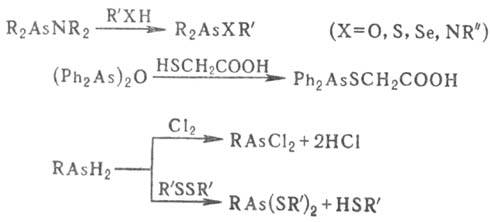
При действии нуклеофилов на перфторалкил- и хлор-виниларсины, а также при действии О 2 или Н 2 при высоких т-рах на Alk3As наблюдается разрыв связи AsЧС.
Органоарсины получают алкилированием соответствующих органоарсенидов или электроф. присоединением гидридов As к непредельным соед., подобное присоединение галогенидов As приводит к галогенорганоарсинам (см., напр., Люизит);R3As м. б. получены р-цией галогенидов As с алкил- или перфторалкилгалогенидами в присут. Na, К, Hg; ArnAsHal3-n -действием AsHal3 на арены в присут. к-т Льюиса; Rn АsСl3-n -взаимод. орг. производных Zn, Pb, Sn, Hg c AsCl3, напр.:
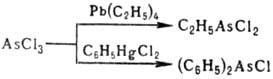
Прямое действие на As или его сплавы алкилгалогенидов используют для синтеза органоарсинов ф-лы (RF)nAsI3_n (RF -перфторалкил, n = 1-3, скорость и направление процесса регулируют добавками I2 или иодидов As). Амиды к-т As получают действием RMgHal на HalnAs(NR2)3-n ( п =1,2).
П р о и з в о д н ы е As с к о о р д и н а ц. ч и с л о м 4. К ним относятся оксиды, тио- и селеноксиды третичных арсинов R3As=X; алкилиденарсораны
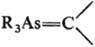 ; арсинимины R3As=NR'; арсониевые соед. [R3 AsX] + Y- (X = R, OH, OR, SR, NH2; Y = Hal, OH, ClO4, NO3 и др.), а также ор-ганоарсоновые и диорганоарсиновые к-ты и их производные.
; арсинимины R3As=NR'; арсониевые соед. [R3 AsX] + Y- (X = R, OH, OR, SR, NH2; Y = Hal, OH, ClO4, NO3 и др.), а также ор-ганоарсоновые и диорганоарсиновые к-ты и их производные.
Большинство соед. четырехкоординац. As-твердые в-ва; раств. в полярных орг. р-рителях, ограниченно раств. в воде; при рН >= 8, как правило, разлагаются. Мн. соли органоарсоновых к-т хорошо раств. в воде; нерастворимость солей щел.-зем. металлов используют в аналит. химии.
Конфигурация молекул соед. четырехкоординац. As-тетраэдр, напр. для (CH3)3AsO длины связей 0,1937 нм (СЧAs), 0,1631 нм (As=O), угол OAsC 112,6°; для (CH3)3As=S 0,1940 нм (СЧAs), 0,2059 нм (As=S), угол SAsC 113,4°; для Ph4As+ 0,191 нм (СЧAs), угол CAsC 106-111°. Соед. с группировкой R3As=X (X = О, S, NR') высокополярны, напр. для Ph3As=O m 18,34.10-30 Кл . м, для Ph3As=S m 11,67.10-30 Кл . м.
Соед. четырехкоординац. As термически менее устойчивы, чем соед. трехкоординац. As, напр. AlknAs(O)Hal3_n отщепляют AlkHal уже при комнатной т-ре. Большинство соед. при 100-250 °С разлагаются или перегруппировываются с образованием, в частности, производных трехкоординац. As, напр.:
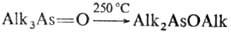
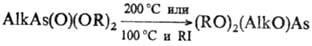
Последняя р-ция известна под назв. "ретроарбузовская" перегруппировка (по направлению противоположна р-ции Арбузова фосфорорг. соед.).
Производные четырехкоординац. As проявляют основные св-ва: протонируются к-тами с образованием арсониевых соед.; образуют аддукты с к-тами Льюиса (напр., с BF3 и S2O3) и солями мн. металлов; алкилируются алкилгалогени-дами, напр.:
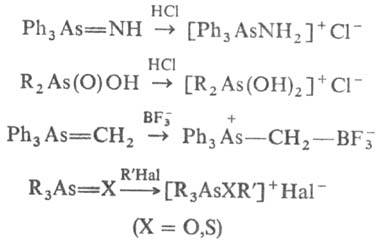
Под действием восстановителей (H2,Ag, SO2, H3PO2, Ph3P и др.) превращаются в соед. трехкоординац. As. При действии электроф. реагентов М. с. типа R3As=X (X = О, S, NR, CR2) легко модифицируются, напр.:
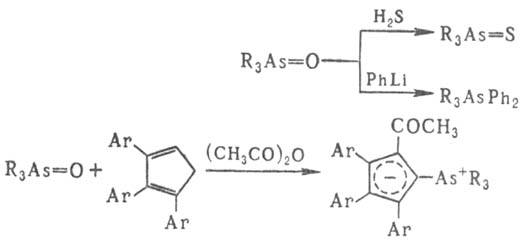
Р-ции алкилиденарсоранов с карбонильными соед. используют для получения олефинов или оксиранов, напр.:
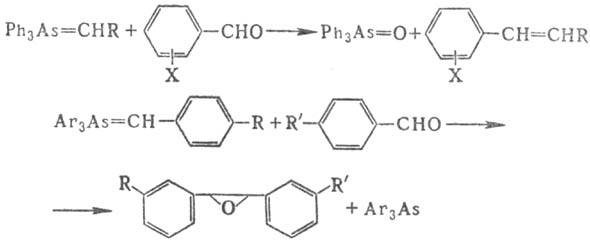
Для получения соед. четырехкоординац. As используют Барта реакцию, р-цию Бешана, а также т. наз. р-цию Мейера-взаимод. алкилгалогенидов с солями к-т As(III): RHal + Na3AsO3
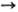 RAsO(ONa)2.
RAsO(ONa)2.
К п р о и з в о д н ы м As с к о о р д и н а ц. ч и с л о м 5 относятся пентаорганоарсораны R5As, нек-рые органоалкоксиарсораны, а также мн. квазиарсониевые соед. (RF)AsHal5-n (Rp-перфторалкил) и RnAsX5-n (X = OCOR, OOR, SR; n == 1-3); соед. RnAsHal5-n, видимо, склонны к образованию ионных форм.
Соед. пятикоординац. As-кристаллич. в-ва, реже-жидкости; раств. во многих орг. р-рителях, разлагаются водой. Большинство соед. в отсутствие влаги устойчивы, при длит. нагревании обычно разлагаются с образованием соед. трехкоординац. As, напр.:
Для соед. пятикоординац. As характерны р-ции замещения, напр.:
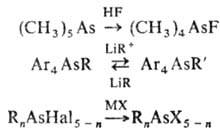
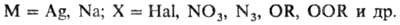
Получают их окислением производных трех- и четырех-координац. As; пентаорганоарсораны получают р-цией квазиарсониевых соед. с LiR.
П р о и з в о д н ы е As с к о о р д и н а ц. ч и с л о м 2 сравнительно мало изучены. К ним относятся арсенин (ф-ла I) и его производные, 1,2,3-диазарсолы (II) и арсаметинцианины (III, IV):
Известные соед. этой группы -кристаллич. в-ва; раств. преим. в полярных орг. р-рителях; устойчивы при комнатной т-ре (за исключением нек-рых производных арсенина, склонных к олигомеризации), многие плавятся без разложения.
В арсенине атом As лежит в плоскости кольца, длины связей 0,185 нм (СЧAs), 0,139-0,140 нм (СЧС), угол CAsC 97,3°.
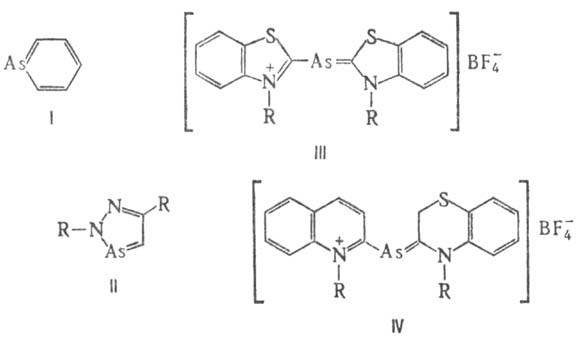
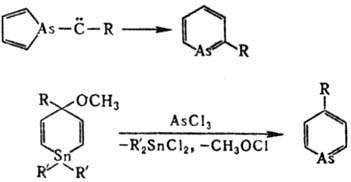
Арсенин и его производные получают перегруппировкой карбенов или из оловоорг. соед.:
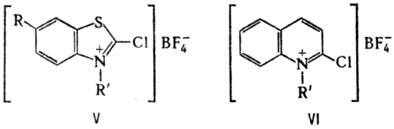
Диазарсолы получают циклоприсоединением AsCl3 к гидразоналканам RNHN=C(R)CH3; арсаметинцианины -взаимод. [(CH3)3Si]3As с тетрафторборатами 2-хлор-З-алкил(бензо-1,3-тиазолия) (V) или 1-алкилхинолиния (VI).
Известны также п р о и з в о д н ы е As с к о о р д и н а ц. ч и с л о м 6. К ним относятся арсенат-анионы AsX-6 (X = OR, Аr). Соед. шестикоординац. As обладают большей устойчивостью, чем соответствующие соед. фосфора.
М. с. применяют в качестве лек. средств (напр., новарсе-нол, миарсенол, минарсон, осарсол), в электронной промети (напр., R3As-для легирования эпитаксиальных слоев кремния), в качестве реагентов в аналит. химии. Иодиды (RF)2AsI предложено использовать в качестве активных сред фотодиссоционных оптических квантовых генераторов.
Первые М. с. синтезированы Л. Коде (1760). Наиб. интенсивно химия М. с. развивалась в нач. 20 в. в связи с обнаружением у ряда М. с. противомикробного, а также раздражающего и кожно-нарывного действия.
Лит.: Фрейдлина Р. X., Синтетические методы в области металлооргани-ческих соединений мышьяка, М.-Л., 1945; Doak G., Freedman L., Organo-metallic compounds of arsenic, antimony and bismuth, N. Y., 1970; Organometallic compounds, 2 ed., v. 3-Compounds of arsenic, antimony and bismuth, suppl. 1, ed. by M. Dub, B.-Hdlb.-N. Y., 1972; Houben-Weyl, Methoden der organischen Chemie, Bd 13, Tl 8, Stuttg., 1978, S. 17-441; Tzschach A., Heinicke J., Arsenheterocyclen, Lpz., 1978. Г. И. Дрозд.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
