- АМИНОАЦИЛ-тРНК-СИНТЕТАЗЫ
[аминокислота: тРНК-лигазы (образующие АМФ)], ферменты класса ли-газ, катализирующие аминоацилирование транспортной РНК (тРНК) по схеме:
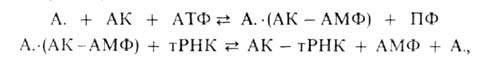
где А. - фермент, АК - активируемая аминокислота, АТФ - аденозинтрифосфат, ПФ - пирофосфат, АМФ - аденозинмонофосфат. Карбоксильная группа аминокислоты в АК-АМФ связана ангидридной связью с остатком фосфорной к-ты (см. ф-лу; R'-ацил аминокислоты, R = Н), а в АК - тРНК - сложноэфирной связью с гидроксильной группой в положении 2' или 3' рибозы концевого остатка аденозина тРНК (в ф-ле R'-продолжение цепи тРНК, R-аминоацил):
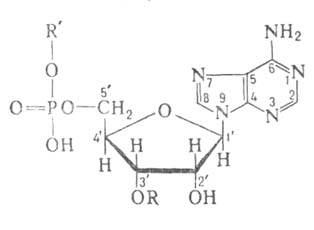
Каждая А. специфична только по отношению к одной из 20 аминокислот, входящих в белки, и к одной или нескольким тРНК.
Большинство А. состоит из 1, 2 или 4 одинаковых полипептидных цепей, а глицил- и фенилаланил-тРНК-синтетазы - из 2, отличающихся друг от друга, пар. Мол. м. полипептидных цепей 30-140 тыс., оптимальная каталитич. активность фермента при рН 7-9; р/ обычно 5-6,5. Многие А. содержат два активных центра. В индивидуальном состоянии выделены А., специфичные к каждой из 20 аминокислот. Известны первичные структуры нескольких А., определенные в осн. из нуклеотидной последовательности кодирующих их генов, и пространств. структуры тирозил-тРНК-синтетазы и участка молекулы метионил-тРНК-синтетазы, обладающего каталитич. активностью.
Специфичность р-ций, катализируемых А., очень высока, что определяет точность белкового синтеза в живой клетке. Если А. осуществит ошибочное аминоацилирование тРНК близкой по структуре аминокислотой, произойдет коррекция путем катализируемого той же А. гидролиза ошибочных АК-тРНК до АК и тРНК. В цитоплазме содержится полный набор А., кодируемых ядерным геномом; в хлоропластах и митохондриях есть свои А.
Лит.: Киселев Л. Л., Фаворова О. О., Лаврик О. И., Биосинтез белков от аминокислот до аминоацил-тРНК, М., 1984: Спирин А. С., Структура рибо-сом и биосинтез белка, Пущино, 1984. 0.0. Фаворова.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
