- ИЗОФТАЛЕВАЯ КИСЛОТА
- (1,3-бензолдикарбоновая к-та, м-фталевая к-та), мол. м. 166,14; бесцв. кристаллы; т. пл. 348 °С; возгоняется; d420 1,507; DH0 сгор - 802 кДж/моль,DH0 субл 106,7 кДж/моль; давление пара (в кПа): 0,009 (100°С), 0,08 (125 °С), 3,98 (290°С); р К а>1 3,62 и р К а>2 4,60 (20 °С); m 7,92.10-30 Кл. м (диоксан; 25 °С);
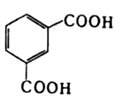
плохо раств. в холодной воде (0,013% по массе), холодной уксусной к-те (0,079% по массе), хорошо -в водных р-рах щелочей (с образованием солей); р-римость в метаноле 2,44% по массе, пропаноле 1,67, в воде при 25 °С динатриевой соли И. к. - 37, дикалиевой соли - 53, диаммониевой - 45% по массе. И. к. обладает всеми св-вами, характерными для карбоновых кислот. При взаимод. со щелочами образует соли, при нагр. со спиртами - эфиры (см. табл.); соли и эфиры И. к. наз. изофталатами. И. к. реагирует с SOCl2 и СОСl2 (кат. - вторичные амины) или СН 3 СОСl при 130 o С, превращаясь в изофталоилхлорид. Восстанавливается Н 2 в уксусной к-те при 15-20°С (кат. - РtO или Pt) в цис -гексагидроизофталевую к-ту С 6 Н 10 (СООН)2, электролитически в водно-спиртовом р-ре Н 2SО 4 - в м-ксилиленгликоль С 6 Н 5 (СН 2 ОН)2. При 220-240°С с избытком бензолсульфамида образует изофталодинитрил, при галогенировании в дымящей Н 2SО 4 - тетрагалогенизофталевую к-ту и гексагалогенбензол (Hal = Сl, Вr, I). Нитруется конц. HNO3 при 30 °С с образованием 5-нитро- и 4-нитроизофталевых к-т (96,9 и 3,1% соотв.), сульфируется дымящей H2SO4 при 200 °С в 5-сульфоизофталевую к-ту. Дикалиевая соль И. к. при 350-460 °С (кат. - К 2SО 4) превращ. в соответствующую соль терефталевой к-ты (р-ция Хенкеля).

В пром-сти И. к. получают: 1) окислением м-ксилола воздухом в уксусной к-те при 100-150 °С и 1,4-2,8 МПа (кат. соль Со, промотор - СН 3 СНО) или при 170-220 °С и 1,5-3,5 МПа (кат. - соли Со и Мn, промотор - Вr2); 2) окислением м-ксилола или м-толуиловой к-ты конц. HNO3 при 200 °С и 4 МПа; 3) окислением 1,3-диизопропилбензола воздухом при 120-220°С (кат. - соли Со и Мn); 4) декарбоксилированием 1,2,4-бензолтрикарбоновой (тримеллитовой) к-ты в водном р-ре NaOH при 250 °С. Выход 90-97%. Техн. И. к. очищают кристаллизацией из уксусной к-ты. И. к. используют гл. обр. для произ-ва ненасыщ. полиэфирных смол, изофталоилхлорида. Диаллилизофталат - сшивающий агент для полиэфирных смол, диметил-, диэтил- и ди(2-этилгексил)изофталаты - пластификаторы. Т. всп. 700 °С (аэрозоль). Раздражает кожу: для ее дикалиевой соли ЛД 50 4,6 г/кг (мыши, перорально). Лит.:Kirk-Othmer encyclopedia, 3 ed., v. 17, N. Y., 1982, p. 758-62. H. Б. Карпова.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
