- ЗОЛОТА ГАЛОГЕНИДЫ
- моногалогениды AuX, где Х - Сl, Вr, I, тригалогениды АuХ 3, где X - F, Cl, Вr, I, пентафторид AuF3, крайне неустойчивый AuF7, а также галогеноаураты(I, III), содержащие анионы [АuХ 2]- или [АuХ 4]-, и гексафтороаураты(V). Моногалогениды - кристаллы; при небольшом нагревании разлагаются (2AuX : 2Au + Х 2, ЗАuХ : АuХ 3 + 2Аu). В воде малорастворимы; раств. в конц. водных р-рах галогеноводородных к-т и галогенидов металлов с образованием малоустойчивых в присут. воды комплексов [AuX2]- , к-рые относительно стабильны в неводных средах (их устойчивость возрастает в ряду Сl < Вr < I). С NH3, пиридином, триалкилфосфинами, СО и др. образуют комплексы. Хлорид AuCl (см. табл.) получают разложением в вакууме Н[АuСl4] при 170-205 °С или нагреванием АuСl3 до 175°С в токе НСl. Бромид AuBr получают нагреванием АuВr3 выше 200°С. Иодид AuI медленно разлагается влагой воздуха; получают взаимод. р-ра Н[АuСl4] с р-ром KI, а также из элементов при 393 °С. Тригалогениды АuХ 3 раств. в водных р-рах НХ и галогенидов металлов, образуя комплексные анионы [AuX4]-; анионы [АuСl4]- и [АuВr4]- устойчивы в водной среде, тетрафторо- и тетраиодоаурат-ионы водой гидролизуются. Галоген в [АuСl4]- и [АuВr4]- легко замещается на др. лиганды. Так, при действии Br2, F2 или KCN на [АlСl4]- образуются соотв. [AuBr4]-, [AuF4]- или [Au(CN4)]- . Тригалогениды образуют комплексы [AuLX3], где L - пиридин, нитрилы; с NH3 дают [Au(NH3)4]3+; AuCl3 и AuBr3 восстанавливаются орг. фосфинами и арсинами, диалкилсульфидами, меркаптанами до соед. Au(I)-[AuLX]. Трифторид AuF3 возгоняется ок. 300°С, разлагается водой, окислитель, сильный фторирующий агент; легко воспламеняет бензол и др. орг. соединения. Получают взаимод. AuCl3, AuCl или Аu с BrF3, XeF2 или F2 при 300-400 °С. Трихлорид АuСl3 димерен; при 180°С возгоняется; раств. в воде, этаноле и эфире; образует дигидрат АuСl3.2Н 2 О (DH0 обр - 715,6 кДж/моль).
СВОЙСТВА ГАЛОГЕНИДОВ ЗОЛОТА
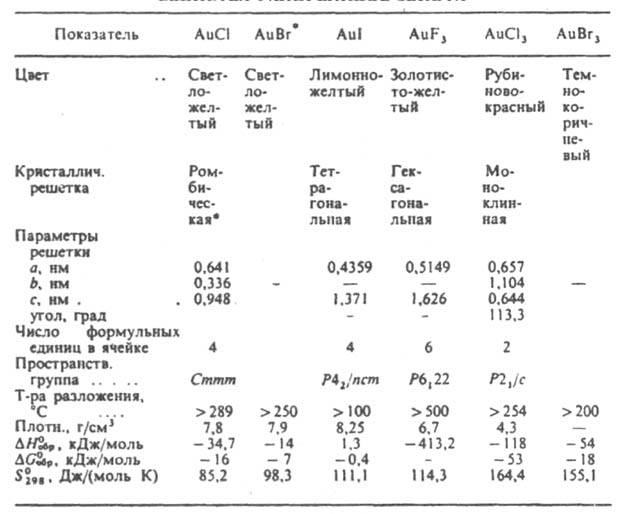
Х Имеются сведения о тетрагональной модификации.При упаривании солянокислого р-ра АuСl3 выделяются желтые кристаллы золотохлористоводородной к-ты Н[АuСl4].3Н 2O (DH0 обр - 1192,9 кДж/моль); известен тетрагидрат Н[АuСl4].4Н 2 О (DH0 обр -1490,2 кДж/моль). Получают АuСl3: из Аu и О 2 при 250 °С; р-цией ICl с Аu при нагр.; взаимод. Н[АuСl4].3Н 2 О с SOCl2 при 70-80 °С. Трихлорид - промежут. продукт при извлечении Аu из руд; его используют для получения коллоидного золота, орг. и неорг. соединений Аu, в т. ч. и лек. ср-в, для нанесения покрытий из Аu. Золотохлористоводородная к-та - промежут. продукт при получении солей Аu, очистке Аu при его получении и регенерации из отходов; ее применяют при гальванич. золочении металлич. пов-стeй, окраске стекла и фарфора. Трибромид AuBr3 разлагается горячей водой. Получают из Аu и Вr2 при 150°С. Трииодид AuI3 неустойчив, разлагается на AuI и I2 Пентафторид AuF5 - красно-коричневые или оранжевые кристаллы; выше 80 °С возгоняется;DH0 обр - 473,4 кДж/моль; взрывается в присут. воды, спирта, эфира; раств. в жидких HF и ВrР 5; сильный окислитель и фторирующий агент; получают термич. разложением гексафтороауратов(V)Х +[АuF6]-, где Х + - О 2+, NO+, IF6+, XeF5+, Xe2F11+, КrF+, Кr2F3+; и др. (производные Кr и Хе получают взаимод. Аu или AuF3 соотв. с КrF2 и ХеF6). Лит. см. при ст. Золото. Ю. М. Киселев.
ЗOЛОТА ЦИАНИДЫ. Цианид золота(I) AuCN -светло-желтые кристаллы; плотн. 7,12 г/см 3 (25 °С); практически не раств. в воде, этаноле и эфире, раств. в р-рах KCN с образованием калия дицианоаурата(I)K[Au(CN)2] и NH3; при нагр. разлагается с выделением Аu; с H2S в кислой среде образует Au2S; получают разложением K[Au(CN)2] 2 М соляной к-той. К-ту H[Au(CN)2] можно получить методом ионного обмена; при 100 °С разлагается на HCN и AuCN. Цианид золотa (III) Au(CN)3.3Н 2 О и его комплексные соед., напр. K[Au(CN)4].1,5Н 2 О (получают при взаимод. р-ра АuСl3 с горячим конц. р-ром KCN), малоустойчивы, разлагаются при 50 °С с выделением Аu; раетв. в воде, этаноле, эфире. Цианаураты (Ш) взаимод. с ионами Сl-, Вr-, I-, образуя [Au(CN)2Hal2]-. Л. С. Стрижко.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
