- АЛЛИЛБОРАНЫ
соединения В(III) общей ф-лы I.
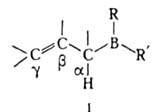
В А. имеется 5 реакционных центров: электроф. атом В, связи ВЧС, С а ЧН, С=С, ВЧR или ВЧR' (R, R'-OAlk, Alk, NAlk2 и т. д.). Взаимное влияние атома В и двойной связи отчетливо проявляется в р-циях с участием бор-аллильной системы в целом. Прочность связи ВЧС в них меньше, чем в алкилборанах (соотв. ~ 285 и ~ 350 кДж/моль).
Различают симметричные (напр., триаллилборан, трикротилборан) и несимметричные, или смешанные, А. К последним относятся, в частности, аллил(диалкил)бораны, диаллил(алкил)бораны, аллил(диалкокси)бораны, три-В-аллилборазол, а также циклим. А. и соед. типа R'XCH=CHCH2BR2, где R = OAlk, SAlk, NAlk2 и R' = Alk, X = О, S.
А. получают переметаллированием, гидроборированием нек-рых алленов, 1,3-диенов, пропаргилгалогенидов и др. методами, напр.:
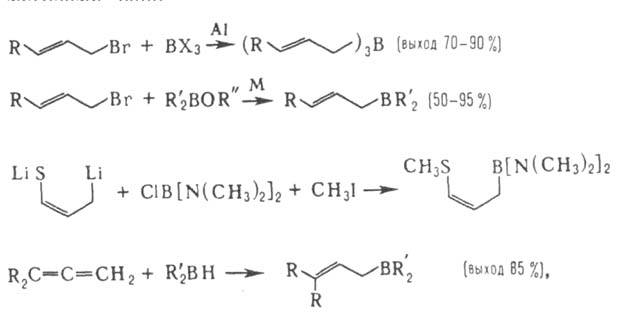
где М = Li, Mg, Al; X = F, Cl, OR; R = H, Alk, Ar, циклоалкил; R' = Alk, Ar, OAlk, NAlk2.
А. легко окисляются и гидролизуются на воздухе, низшие члены ряда самовоспламеняются. Большинство А. расщепляется водой, спиртами, р-рами щелочей и к-т с образованием соответствующих олефинов.
А.-более сильные к-ты Льюиса, чем их алкильные аналоги; они образуют комплексы с аминами, нек-рыми эфи-
рами, сульфидами, фосфинами. При действии RLi получаются бораты
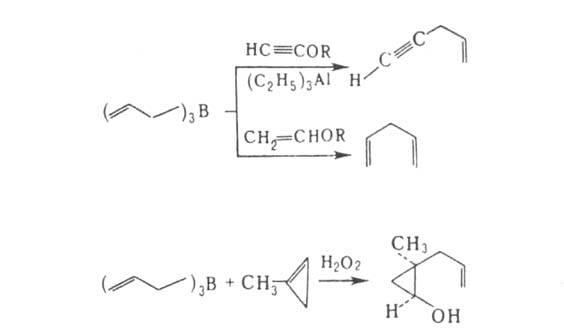
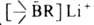 . Комплексообразование - первый акт р-ций А. с нуклеоф. реагентами (Н 2 О, ROH, RSH, R2NH, RCHO, RCN, RC=CH и др.).
. Комплексообразование - первый акт р-ций А. с нуклеоф. реагентами (Н 2 О, ROH, RSH, R2NH, RCHO, RCN, RC=CH и др.). Связь ВЧС разрывается (без перегруппировки) при взаи-мод. А. с Н 2 О 2 (синтез аллильных спиртов), N2CHCOOR' (синтез эфиров RCH=CHCH2CH2COOR'), циклопропенами или бициклобутаном:
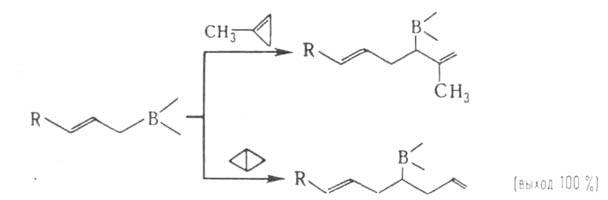
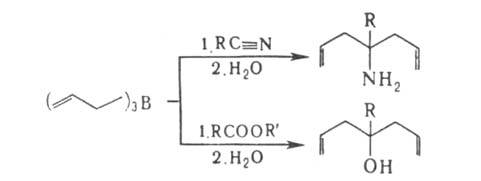
К р-циям А. по двойной связи относятся полимеризация, диеновая конденсация, гидрирование, присоединение меркаптанов, Вr2, гидридов Ge, Si и В, напр.:
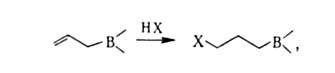
где X = Н, RS, R3Si, R3Ge, R2B.
По связи
 ЧН, активированной бором, идет металлирование (обычно 2,2,5,5-тетраметилпиперидиллитием с послед. алкилированием).
ЧН, активированной бором, идет металлирование (обычно 2,2,5,5-тетраметилпиперидиллитием с послед. алкилированием). В смешанных А. со связью ВЧXR (X = О, S и др.) легко обменивается заместитель XR.
Все р-ции с участием бор-аллильной системы сопровождаются аллильной перегруппировкой. К ним относятся: 1. Протолитич. расщепление водой, спиртами, аминами, меркаптанами, карбоновыми к-тами; используется для синтеза
 олефинов через А. 2. Аллилборирование альдегидов, кетонов, сложных эфиров, хинонов, нитрилов, иминов, виниловых эфиров, циклопропенов и ацетиленов; при этом В локализуется у нуклеоф. центра кратной связи, а аллильная группа-у электрофильного:
олефинов через А. 2. Аллилборирование альдегидов, кетонов, сложных эфиров, хинонов, нитрилов, иминов, виниловых эфиров, циклопропенов и ацетиленов; при этом В локализуется у нуклеоф. центра кратной связи, а аллильная группа-у электрофильного: 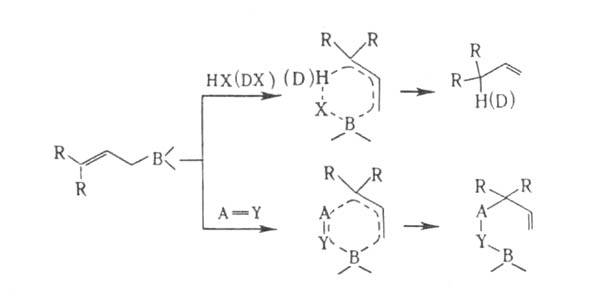
где НХ = Н 2 О, ROH, RNH2 и др.; A=Y = С=О, С
 N, C=N, C=C, С
N, C=N, C=C, С 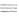 С или циклопропан.
С или циклопропан. Аллилборирование применяется для получения гомоаллильных спиртов и аминов, 1,4-диенов, аллилацетиленов и др., напр.:
Важнейшая р-ция триаллилборана и его гомологов (триметаллилборана и др.)-аллилбор-ацетиленовая конденсация, приводящая к соединениям ряда 3-борабицикло[3.3.1]-нон-6-ена:
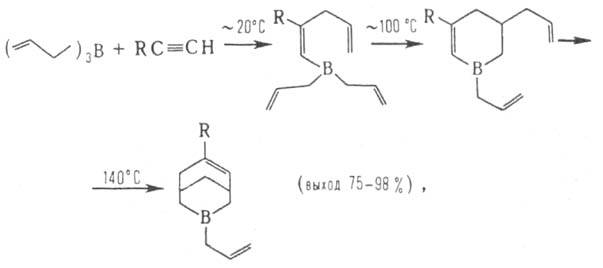
где R = Н, D, Alk, Ar и др.
При взаимод. триаллилборана с алленом получается 3-аллил-7-метилен-3-борабицикло[3.3.1]нонан, из к-рого был впервые синтезирован 1-бораадамантан:
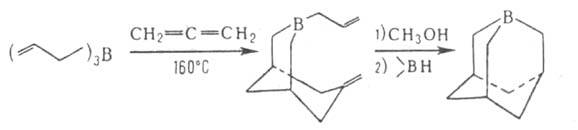
3. Изомеризация
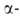 замещенных А. в термодинамически более устойчивые изомеры, в к-рых В присоединен к менее замещенному атому С; напр.:
замещенных А. в термодинамически более устойчивые изомеры, в к-рых В присоединен к менее замещенному атому С; напр.: 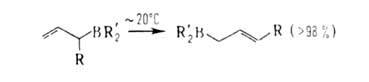
4. Внутримол. перманентная аллильная перегруппировка (ПАП)-быстрая миграция В от С 1 к С 3 с одноврем. перемещением двойной связи:
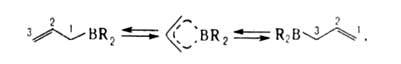
где R-аллил, алкил. При 20 и 200
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
