- Окиси органические
-
(хим.). — О. органическими вообще называются вещества, содержащие один или несколько остатков вида:
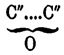 ; они изомерны с соответственными альдегидами и кетонами и метамерны (см. Изомерия) с непредельными простыми и смешанными эфирами. Одноокиси предельных углеводородов, вещества общей формулы СnН2nО, получаются обыкновенно отнятием элементов хлористого водорода от хлоргидринов гликолей (см.) крепким раствором едкой щелочи (Вюрц), поташа (Фаворский) и иногда твердым едким кали (хлоргидрин тетраметилэтиленгликоля — Эльтеков). Необходимые для этого хлоргидрины могут быть получены или насыщением соляной кислотой гликолей при нагревании: CnH2n(OH)2 + HCl = C2H2nCl(OH) + H2O (Вюрц) [Необходимо иметь в виду, что при избытке соляной кислоты и достаточно долгом нагревании обыкновенный гликоль дает. хлористый этилен: С2Н4(ОН)2 + 2HCl = С2Н4Cl2 + 2Н2O (Шорлеммер).], или присоединением элементов хлорноватистой кислоты к этиленным углеводородам: СnН2n + ClOH = СnН2nCl(ОН) (Кариус, Эльтеков и др.). Большинство окисей могут быть получены только методом Вюрца (ср. о действии водоотнимающих средств на гликоли), но некоторые образуются при нагревании гликолей с серной кислотой следующей реакцией, подобной реакции образования простых эфиров; так, γ-O. нормального амилена (1,4-оксипентан) — из нормального амиленгликоля:
; они изомерны с соответственными альдегидами и кетонами и метамерны (см. Изомерия) с непредельными простыми и смешанными эфирами. Одноокиси предельных углеводородов, вещества общей формулы СnН2nО, получаются обыкновенно отнятием элементов хлористого водорода от хлоргидринов гликолей (см.) крепким раствором едкой щелочи (Вюрц), поташа (Фаворский) и иногда твердым едким кали (хлоргидрин тетраметилэтиленгликоля — Эльтеков). Необходимые для этого хлоргидрины могут быть получены или насыщением соляной кислотой гликолей при нагревании: CnH2n(OH)2 + HCl = C2H2nCl(OH) + H2O (Вюрц) [Необходимо иметь в виду, что при избытке соляной кислоты и достаточно долгом нагревании обыкновенный гликоль дает. хлористый этилен: С2Н4(ОН)2 + 2HCl = С2Н4Cl2 + 2Н2O (Шорлеммер).], или присоединением элементов хлорноватистой кислоты к этиленным углеводородам: СnН2n + ClOH = СnН2nCl(ОН) (Кариус, Эльтеков и др.). Большинство окисей могут быть получены только методом Вюрца (ср. о действии водоотнимающих средств на гликоли), но некоторые образуются при нагревании гликолей с серной кислотой следующей реакцией, подобной реакции образования простых эфиров; так, γ-O. нормального амилена (1,4-оксипентан) — из нормального амиленгликоля: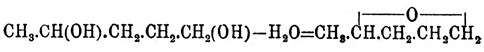 (Перкин и Фреер, Липп),окись пентаметилена — из пентаметиленгликоля:
(Перкин и Фреер, Липп),окись пентаметилена — из пентаметиленгликоля: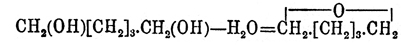 (Демьянов),δ-O. нормального иксилена (1,5-оксигексан) — из δ-(норм.)-гексиленгликоля (Липп) и т. д.; наконец, некоторые одноокиси образуются присоединением элементов воды (под влиянием серной кислоты) к соответственным углеводородам ряда СnН2n-2; так, псевдоокись гексилена получается при взбалтывании с серной кислотою диаллила:
(Демьянов),δ-O. нормального иксилена (1,5-оксигексан) — из δ-(норм.)-гексиленгликоля (Липп) и т. д.; наконец, некоторые одноокиси образуются присоединением элементов воды (под влиянием серной кислоты) к соответственным углеводородам ряда СnН2n-2; так, псевдоокись гексилена получается при взбалтывании с серной кислотою диаллила: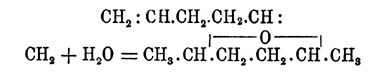 (?) (Джекиль, Бэгаль),окись диизокротила при взбалтывании диизокротила (и диизобутенила) с серной кислотой, разбавленной на два объема одним объемом воды:
(?) (Джекиль, Бэгаль),окись диизокротила при взбалтывании диизокротила (и диизобутенила) с серной кислотой, разбавленной на два объема одним объемом воды: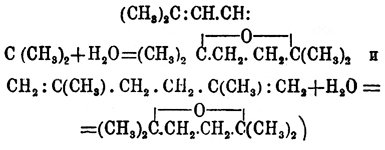 (Фаворский, Погоржельский).Предельные одноокиси, известные до сих пор, представляют жидкости, обладающие приятным, отчасти эфирным запахом; гомологическая разность их точек кипения около 20°; так, О. этилена кипит при 13,5°, О. пропилена — при 35°, О. бутиленов — при 51-52° и 56-57°, О. амиленов от 75° до 82° и т. д. Замечательна близость точек кипения изомеров, особенно ясно видимая на температуре кипения О. С5Н10О (О. триметилэтилена при 75-76°, γ-О. нормального амилена кипит при 77-78°, О. симметричного метилэтилэтилена — при 80°, пентаметилена при 81-82° и О. изопропилэтилена — при 82°). По химическому характеру предельные одноокиси могут быть разделены, по-видимому, на два класса. К первому должны быть отнесены типичные одноокиси, приближающиеся к альдегидам и кетонам: все они могут быть получены из гликолей только косвенным путем, переходя через хлоргидрины. Во втором можно считать все окиси, которые образуются дегидратацией гликолей под влиянием серной кислоты, а равным образом, вероятно, и те, которые получаются присоединением элементов воды к некоторым углеводородам ряда СnН2n-2; все эти О. по своим свойствам ближе всего стоят к простым (смешанным) эфирам (Анри).Типичные О., содержащие группу
(Фаворский, Погоржельский).Предельные одноокиси, известные до сих пор, представляют жидкости, обладающие приятным, отчасти эфирным запахом; гомологическая разность их точек кипения около 20°; так, О. этилена кипит при 13,5°, О. пропилена — при 35°, О. бутиленов — при 51-52° и 56-57°, О. амиленов от 75° до 82° и т. д. Замечательна близость точек кипения изомеров, особенно ясно видимая на температуре кипения О. С5Н10О (О. триметилэтилена при 75-76°, γ-О. нормального амилена кипит при 77-78°, О. симметричного метилэтилэтилена — при 80°, пентаметилена при 81-82° и О. изопропилэтилена — при 82°). По химическому характеру предельные одноокиси могут быть разделены, по-видимому, на два класса. К первому должны быть отнесены типичные одноокиси, приближающиеся к альдегидам и кетонам: все они могут быть получены из гликолей только косвенным путем, переходя через хлоргидрины. Во втором можно считать все окиси, которые образуются дегидратацией гликолей под влиянием серной кислоты, а равным образом, вероятно, и те, которые получаются присоединением элементов воды к некоторым углеводородам ряда СnН2n-2; все эти О. по своим свойствам ближе всего стоят к простым (смешанным) эфирам (Анри).Типичные О., содержащие группу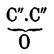 , способны, присоединяя элементы воды, переходить в отвечающие им гликоли; присоединение это идет более или менее легко в зависимости от строения О. Так, О. пропилена и псевдобутилена
, способны, присоединяя элементы воды, переходить в отвечающие им гликоли; присоединение это идет более или менее легко в зависимости от строения О. Так, О. пропилена и псевдобутилена  и
и 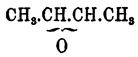 соединяются с водой на холоде очень медленно, О. изобутилена и триметилэтилена
соединяются с водой на холоде очень медленно, О. изобутилена и триметилэтилена 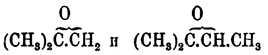 легко уже соединяются на холоде, а О. тетраметилэтилена
легко уже соединяются на холоде, а О. тетраметилэтилена 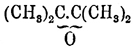 соединяется с очень сильным выделением тепла, и, можно думать, что наименьшей энергией к соединению с водой обладают О. первичных и вторичных и первично-вторичных гликолей, а наибольшей — окиси третичных гликолей, О. же первично и вторично-третичных занимают середину (Эльтеков). Кроме способности к соединению с водой, типичные О. отличаются еще от альдегидов [Обыкновенно способностью к образованию гидратов обладают замещенные альдегиды и кетоны; так CCl3.СОН дает (легко) хлоралгидрат — CCl3.CH(ОН)2, а оксиизобутиловый альдегид (трудно) — гидрат: (СН3)2.C(ОН).CH(ОН)2 (Горбов и Кесслер), мезоксалевая кислота НО2С.СО.CO2Н — гидрат — НО2С.C(ОН)2СО2Н (Петриев).] и кетонов неспособностью реагировать с гидроксиламином и фенилгидразином (В. Мейер, ср. ниже о двуокиси эритрена). Остальные их реакции общи с реакциями альдегидов и кетонов. Так, например, О. этилена (см.) окисляется подобно альдегиду (Вюрц) в кислоту (гликолевую), но присоединяет она при этом не атом, а частицу кислорода О2, уподобляясь в этом отношении уже некоторым кетонам, например дибензилкетону — С6Н5.CH2.СО.CH2.С6Н5, который, окисляясь кислородом воздуха в присутствии едкой щелочи, дает соль бензилфенилгликолевой кислоты:C6H5CH2.CO.CH2C6H5 + KOH + O2 = (C6H5.CH2)(C6H5).С(ОН).СООК + Н2О (Богдановская) [Образование замещенных гликолевых кислот при окислении кетонов и при других окислителях — вероятно, по крайней мере, только этим можно объяснить, что Вюрц, окисляя псевдобутиленгликоль азотной кислотой, получил оксимасляную кислоту, образование метилэтилкетона из псевдобутиленгликоля несомненно и следовательно ряд реакций можно выразить так:СН3.CH(ОН).CH(ОН).CH3 — Н2О = СН3.СО.CH2.СН3 иСН3.СО.CH2.СН3 + O2 = (СН3)2C(ОН).COOH (?).Возможно, что этим объясняется и двойственность в реакции окисления кетонов, доказанная Е. Вагнером.]. Подобно альдегидам и кетонам, типичные О. способны соединяться с аммиаком, синильной кислотой, галоидоводородными кислотами (ср. О. этилена). Способность к полимеризации, сильно развитая у альдегидов, наблюдается и для О.; так, например, соединяя О. этилена на холоде с бромом, а затем отнимая бром от образующегося кристаллического вещества, состава C4H8O2Br2, металлической ртутью (или сероводородом), Вюрц получил бесцветную жидкость, обладающую слабым, приятным запахом, кристаллизующуюся при охлаждении и плавящуюся затем при +9°; температура кипения ее при 102° Ц.; в химическом отношении она индифферентна и Вюрц считает ее за удвоенный полимер О. этилена или настоящий простой эфир гликоля:
соединяется с очень сильным выделением тепла, и, можно думать, что наименьшей энергией к соединению с водой обладают О. первичных и вторичных и первично-вторичных гликолей, а наибольшей — окиси третичных гликолей, О. же первично и вторично-третичных занимают середину (Эльтеков). Кроме способности к соединению с водой, типичные О. отличаются еще от альдегидов [Обыкновенно способностью к образованию гидратов обладают замещенные альдегиды и кетоны; так CCl3.СОН дает (легко) хлоралгидрат — CCl3.CH(ОН)2, а оксиизобутиловый альдегид (трудно) — гидрат: (СН3)2.C(ОН).CH(ОН)2 (Горбов и Кесслер), мезоксалевая кислота НО2С.СО.CO2Н — гидрат — НО2С.C(ОН)2СО2Н (Петриев).] и кетонов неспособностью реагировать с гидроксиламином и фенилгидразином (В. Мейер, ср. ниже о двуокиси эритрена). Остальные их реакции общи с реакциями альдегидов и кетонов. Так, например, О. этилена (см.) окисляется подобно альдегиду (Вюрц) в кислоту (гликолевую), но присоединяет она при этом не атом, а частицу кислорода О2, уподобляясь в этом отношении уже некоторым кетонам, например дибензилкетону — С6Н5.CH2.СО.CH2.С6Н5, который, окисляясь кислородом воздуха в присутствии едкой щелочи, дает соль бензилфенилгликолевой кислоты:C6H5CH2.CO.CH2C6H5 + KOH + O2 = (C6H5.CH2)(C6H5).С(ОН).СООК + Н2О (Богдановская) [Образование замещенных гликолевых кислот при окислении кетонов и при других окислителях — вероятно, по крайней мере, только этим можно объяснить, что Вюрц, окисляя псевдобутиленгликоль азотной кислотой, получил оксимасляную кислоту, образование метилэтилкетона из псевдобутиленгликоля несомненно и следовательно ряд реакций можно выразить так:СН3.CH(ОН).CH(ОН).CH3 — Н2О = СН3.СО.CH2.СН3 иСН3.СО.CH2.СН3 + O2 = (СН3)2C(ОН).COOH (?).Возможно, что этим объясняется и двойственность в реакции окисления кетонов, доказанная Е. Вагнером.]. Подобно альдегидам и кетонам, типичные О. способны соединяться с аммиаком, синильной кислотой, галоидоводородными кислотами (ср. О. этилена). Способность к полимеризации, сильно развитая у альдегидов, наблюдается и для О.; так, например, соединяя О. этилена на холоде с бромом, а затем отнимая бром от образующегося кристаллического вещества, состава C4H8O2Br2, металлической ртутью (или сероводородом), Вюрц получил бесцветную жидкость, обладающую слабым, приятным запахом, кристаллизующуюся при охлаждении и плавящуюся затем при +9°; температура кипения ее при 102° Ц.; в химическом отношении она индифферентна и Вюрц считает ее за удвоенный полимер О. этилена или настоящий простой эфир гликоля: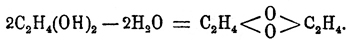 .С еще большей яркостью наклонность к полимеризации проявляется в способности О. этилена давать при действии малых количеств воды полиэтиленовые гликоли (см.)2C2H4(ОН)2 — Н2О = HO.C2.H4.О.С2Н4.ОН3С2H4(ОН)2 — 3Н2О = (HO)С2H4. О.C2H4.O.C2H4(OH)и т. д. "Мы видим, говорит Вюрц, в этом новое свойство этилэна". Он "обладает способностью накопляться в соединениях, образуя тела... все более и более сложных типов... Это общее свойство многоатомных радикалов... Между минеральными группами, одаренными этим свойством, упомянем о сульфуриле, хромиле, фосфориле, существование которых можно допустить в следующих соединениях:
.С еще большей яркостью наклонность к полимеризации проявляется в способности О. этилена давать при действии малых количеств воды полиэтиленовые гликоли (см.)2C2H4(ОН)2 — Н2О = HO.C2.H4.О.С2Н4.ОН3С2H4(ОН)2 — 3Н2О = (HO)С2H4. О.C2H4.O.C2H4(OH)и т. д. "Мы видим, говорит Вюрц, в этом новое свойство этилэна". Он "обладает способностью накопляться в соединениях, образуя тела... все более и более сложных типов... Это общее свойство многоатомных радикалов... Между минеральными группами, одаренными этим свойством, упомянем о сульфуриле, хромиле, фосфориле, существование которых можно допустить в следующих соединениях: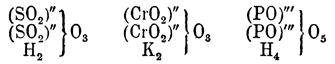 Такая же роль кремния в различных кремневых гидратах и во множестве силикатов, как можно судить по табличке:
Такая же роль кремния в различных кремневых гидратах и во множестве силикатов, как можно судить по табличке: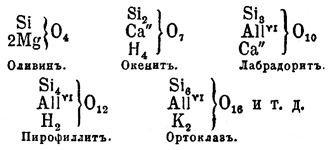 [All Вюрц придал атомный вес 54,8, а следовательно, All = Al2.]Видно, какое разнообразие силикатов мыслимо и может быть предвидено этой теорией. Их конституция и формулы, которые ее выражают, не всегда просты..., но прост и рационален способ их образования, который покоится на накоплении многоатомных радикалов.... Обратим еще внимание на роль, которую играет в образовании всех этих веществ последовательная дегидратация гидратов с многоатомными радикалами в составе. [Возможность уплотнения при дегидратации объясняется деятельностью двухатомного кислорода, что особенно последовательно проводилось А. М. Бутлеровым на целом ряде ангидро-гидратов.].К одноокисям тесно примыкают по своим свойствам двуокиси, например двуокись эритрена —
[All Вюрц придал атомный вес 54,8, а следовательно, All = Al2.]Видно, какое разнообразие силикатов мыслимо и может быть предвидено этой теорией. Их конституция и формулы, которые ее выражают, не всегда просты..., но прост и рационален способ их образования, который покоится на накоплении многоатомных радикалов.... Обратим еще внимание на роль, которую играет в образовании всех этих веществ последовательная дегидратация гидратов с многоатомными радикалами в составе. [Возможность уплотнения при дегидратации объясняется деятельностью двухатомного кислорода, что особенно последовательно проводилось А. М. Бутлеровым на целом ряде ангидро-гидратов.].К одноокисям тесно примыкают по своим свойствам двуокиси, например двуокись эритрена —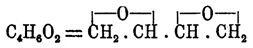 , полученная Пржибытком при действии сухого едкого кали на дихлоргидрин эритрита: CH2Cl.СН(ОН).СН(ОН).СН2Cl — 2HCl = С4Н6О2; она представляет подвижную, приятно пахнущую жидкость, кипящую при 138°, которая при 100°, соединяясь с водой, легко превращается в эритрит, с соляною кислотой образует обратно дихлоргидрин эритрита, с синильной кислотой — нитрил диоксиадипиновой кислоты: С4Н6О2 + 2HCN = CN.СН2CH(ОН).CH(ОН).CH2CN (?), с бромом кристаллический лимонно-желтый продукт присоединения, формулы С4Н6О2Br2 и при нагревании, особенно легко в присутствии солей, превращается в полимер, представляющий аморфное бесцветное тело, не имеющее вкуса, запаха, весьма твердое и нерастворимое в воде, спирте, эфире и хлороформе; от О. этилена двуокись эритрена отличается способностью реагировать со свободным гидроксиламином, образуя вещество состава С4Н12N2О4 = NH(OH).СН2.СН(ОН).СН(ОН).СН2NH(ОН) (?) (Пржибытек). Двуокиси диаллила С6Н10О2, диизобутенила и диизокротила C8H14O2 в значительной мере напоминают двуокись эритрена (Пржибытек). Трехокисей до сих пор неизвестно. Одноокиси, принадлежащие к типу эфиров, до сих пор еще слишком мало исследованы. Из производных одноокисей можно упомянуть о глицидных кислотах, лактонах (см.) и о глюкозидах. Глицидные кислоты, названные так по первому члену — кислоте глицидной (оксиакриловой) —
, полученная Пржибытком при действии сухого едкого кали на дихлоргидрин эритрита: CH2Cl.СН(ОН).СН(ОН).СН2Cl — 2HCl = С4Н6О2; она представляет подвижную, приятно пахнущую жидкость, кипящую при 138°, которая при 100°, соединяясь с водой, легко превращается в эритрит, с соляною кислотой образует обратно дихлоргидрин эритрита, с синильной кислотой — нитрил диоксиадипиновой кислоты: С4Н6О2 + 2HCN = CN.СН2CH(ОН).CH(ОН).CH2CN (?), с бромом кристаллический лимонно-желтый продукт присоединения, формулы С4Н6О2Br2 и при нагревании, особенно легко в присутствии солей, превращается в полимер, представляющий аморфное бесцветное тело, не имеющее вкуса, запаха, весьма твердое и нерастворимое в воде, спирте, эфире и хлороформе; от О. этилена двуокись эритрена отличается способностью реагировать со свободным гидроксиламином, образуя вещество состава С4Н12N2О4 = NH(OH).СН2.СН(ОН).СН(ОН).СН2NH(ОН) (?) (Пржибытек). Двуокиси диаллила С6Н10О2, диизобутенила и диизокротила C8H14O2 в значительной мере напоминают двуокись эритрена (Пржибытек). Трехокисей до сих пор неизвестно. Одноокиси, принадлежащие к типу эфиров, до сих пор еще слишком мало исследованы. Из производных одноокисей можно упомянуть о глицидных кислотах, лактонах (см.) и о глюкозидах. Глицидные кислоты, названные так по первому члену — кислоте глицидной (оксиакриловой) — 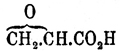 , получаются (Меликов, Эрленмейер) общим методом получения одноокисей с той лишь разницей, что вместо углеводорода ряда этилена (СnН2n) — для образования хлоргидрина берут кислоту акрилового ряда (СnН2n-1.СО2Н), присоединяют к ней хлорноватистую кислоту: СnН2n-1.СО2Н + HClO = СnН2n-1Cl(OH).СО2Н и от полученной хлороксикислоты отнимают элементы хлористого водорода едким кали: СnН2n-1.Cl(OH).СО2Н — HClO = СnН2n-1(O).CO2H. Все известные до сих пор глицидные кислоты легко соединяются с элементами воды, образуя диоксикислоты:СnН2n-1(O).СО2Н + Н2О = СnН2n-1(OH).СО2 , гомологи глицериновой кислоты (см.), и, следовательно, должны быть причислены к производным типичных О. Что касается глюкозидов (см.) или, вернее, их искусственных представителей, образующихся при взаимодействии глюкозы и ее изомеров со спиртами, альдегидами и кетонами, то Э. Фишер (и Мархлевский) считает, что в состав их входят не альдозы и кетозы (см. Гидраты углерода), а изомерные с ними γ-О. (эфирные О., следовательно) и придает, например, глюкозидам d-глюкозы общую формулу:
, получаются (Меликов, Эрленмейер) общим методом получения одноокисей с той лишь разницей, что вместо углеводорода ряда этилена (СnН2n) — для образования хлоргидрина берут кислоту акрилового ряда (СnН2n-1.СО2Н), присоединяют к ней хлорноватистую кислоту: СnН2n-1.СО2Н + HClO = СnН2n-1Cl(OH).СО2Н и от полученной хлороксикислоты отнимают элементы хлористого водорода едким кали: СnН2n-1.Cl(OH).СО2Н — HClO = СnН2n-1(O).CO2H. Все известные до сих пор глицидные кислоты легко соединяются с элементами воды, образуя диоксикислоты:СnН2n-1(O).СО2Н + Н2О = СnН2n-1(OH).СО2 , гомологи глицериновой кислоты (см.), и, следовательно, должны быть причислены к производным типичных О. Что касается глюкозидов (см.) или, вернее, их искусственных представителей, образующихся при взаимодействии глюкозы и ее изомеров со спиртами, альдегидами и кетонами, то Э. Фишер (и Мархлевский) считает, что в состав их входят не альдозы и кетозы (см. Гидраты углерода), а изомерные с ними γ-О. (эфирные О., следовательно) и придает, например, глюкозидам d-глюкозы общую формулу: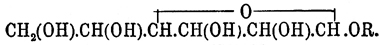 ,а диацетонарабинозе — формулу:
,а диацетонарабинозе — формулу:![[Свободные глюкозы Э. Фишер считает по-прежнему за многоатомные альдегиды и кетоны (ср. Гидраты углерода), во-первых, потому, что по его мнению, такой взгляд наглядно представляет превращения этих веществ, а также потому, что Виллье и Файоль показали, что при соблюдении известных предосторожностей (см. Углеводы) алдозы окрашивают растворы фуксиносернистой кислоты, подобно заведомым альдегидам.] (см. подробнее Углеводы).](/pictures/brokgauz_efron/b42_811-4.jpg) [Свободные глюкозы Э. Фишер считает по-прежнему за многоатомные альдегиды и кетоны (ср. Гидраты углерода), во-первых, потому, что по его мнению, такой взгляд наглядно представляет превращения этих веществ, а также потому, что Виллье и Файоль показали, что при соблюдении известных предосторожностей (см. Углеводы) алдозы окрашивают растворы фуксиносернистой кислоты, подобно заведомым альдегидам.] (см. подробнее Углеводы).Между сложными двуокисями особняком стоять оксэтоны (см.).А. Горбов. Δ.
[Свободные глюкозы Э. Фишер считает по-прежнему за многоатомные альдегиды и кетоны (ср. Гидраты углерода), во-первых, потому, что по его мнению, такой взгляд наглядно представляет превращения этих веществ, а также потому, что Виллье и Файоль показали, что при соблюдении известных предосторожностей (см. Углеводы) алдозы окрашивают растворы фуксиносернистой кислоты, подобно заведомым альдегидам.] (см. подробнее Углеводы).Между сложными двуокисями особняком стоять оксэтоны (см.).А. Горбов. Δ.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907.
