- Реакция Манниха
-
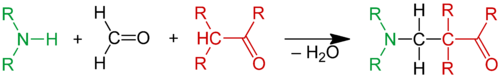
Реакция Манниха - метод аминометилирования енолизующихся карбонильных соединений с образованием β-аминокарбонильных соединений - оснований Манниха. Реакция открыта в 1912 г. Карлом Маннихом при действии формальдегида и вторичных аминов на кетоны (первоначально - антипирин) [1]:
В настоящее время реакция Манниха используется для аминометилирования не только карбонильных соединений, но и различных C-нуклеофилов - алифатических нитросоединений, ацетиленов, α-алкилпиридинов, фенолов, электронизбыточных гетероциклических соединений, при этом аминоалкилирование может происходить как действием смеси неенолизирующегося альдегида и вторичного амина, так и действием иминиевых солей.
Содержание
Механизм
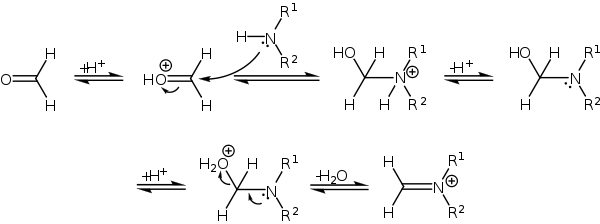
В классическом варианте реакция Манниха трехкомпонентная конденсация, в которой участвуют кетон, формальдегид и вторичный амин либо в условиях кислотного катализа.
Взаимодействие формальдегида и амина ведет к образованию соли α-метилоламина, которая отщепляет воду, образуя диалкилметилениминиевую соль, являющуюся сильным электрофилом:
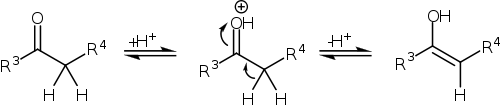
В свою очередь, в кислых условиях происходит енолизация кетона с образованием нуклеофильного енола:
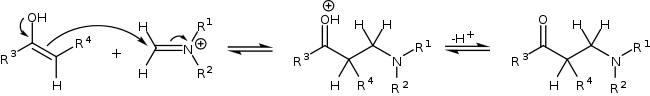
после чего иминиевый ион атакует C-нуклеофильный центр енола с образованием основания Манниха:
Модификации
Кроме смеси формальдегида и вторичного амина, образующих иминиевую соль, для проведения реакции Манниха используются и их синтетические эквиваленты, например, бис(диметиламино)метан, который при обработке трифторуксусной кислотой образует трифторацетат диметилметилидениминиевой соли, являющийся активным электрофилом:
- (CH3)2NCH2N(CH3)2 + 2 CF3COOH
 CH2=N+(CH3)2 • CF3COO- + (CH3)2NH+2 • CF3COO- ,
CH2=N+(CH3)2 • CF3COO- + (CH3)2NH+2 • CF3COO- ,
аналогичным образом бис(диметиламино)метан применяется в комбинации и с другими кислотами (в частности, фосфорной при диаминометилировании ферроцена[2]).
Поскольку в классическом варианте реакция Манниха происходит с выделением воды и, как правило, в кислотных условиях, то в некоторых случаях в реакции в качестве электрофильного агента используются заранее синтезированные иминиевые соли, например, коммерчески доступную соль Эшенмозера (йодид диметилметилиденаммония H2C=N+(CH3)2 I-). Использование таких солей снимает ограничения классического варианта реакции Манниха и позволяет проведение диаминометилирования в некислотных и безводных условиях, например, в случае образуемых in situ силилированных эфиров енолов либо при взаимодействии с литийорганическими соединениями:
- BuLi + H2C=N+(CH3)2 I-
 BuCH2N(CH3)2 + LiI
BuCH2N(CH3)2 + LiI
В качестве CH-кислотных компонент в реакции Манниха кроме карбонильных соединений могут быть использованы алифатические нитросоединения:
- R2CHNO2 + CH2O + HNR12
 R2C(NO2)CH2NR12 + H2O ,
R2C(NO2)CH2NR12 + H2O ,
- RC≡CH + CH2O + HNR12
 RC≡CCH2NR12
RC≡CCH2NR12
и электронизбыточные ароматические (например, фенолы, ферроцены) и гетероциклические соединения; так, например, диаминометилирование индола по Манниху ведет к образованию алкалоида грамина:
Еще одним вариантом реакции Манниха, в которой вместо комбинации формальдегида с первичными алифатическими аминами используется комбинация ароматических альдегидов и аминов является аминобензилирование фенолов по Бетти[3]:
При замене вторичных аминов на тиолы протекает реакция, аналогичная в реакции Манниха, ведущая к образованию замещенных сульфидов, в роли CH-компонент в этой модификации выступают электронобогащенные ароматические и гетероциклические соединения (β-нафтол, индол):[4]
- R1H + CH2O + R2SH
 R1CH2SR2 + H2O
R1CH2SR2 + H2O
Синтетическое применение
Продукты реакции - основания Манниха - нашли широкое применение в органическом синтезе.
Так, метилированием оснований Манниха с дальнейшим расщеплением по Гофману образовавшихся четвертичных аммониевых солей является методом синтеза енонов (α-метиленкарбонильных соединений):
- XCOCHR-CH2N(CH3)2 + CH3I
 XCOCHR-CH2N+(CH3)3 I-
XCOCHR-CH2N+(CH3)3 I- - XCOCHR-CH2N+(CH3)3 I- + B-
 XCOC(R)=CH2
XCOC(R)=CH2
Такой подход использовался, в частности, для введения в метиленового фрагмента в α-положение по отношению к альдегидной группе при синтезе бреветоксинов A[5] и B[6].
Реакция Манниха широко применяется в синтезе гетероциклических соединений - в том числе и при биомиметическом синтезе природных соединений как метод построения углеродного или гетероциклического скелета. Так, синтез тропинона по Робинсону из янтарного диальдегида, ацетондикарбоновой кислоты и метиламина представляет собой модифицированный вариант реакции Манниха, в которой циклическая иминиевая соль, образующаяся из янтарного диальдегида, алкилирует енольную форму ацетондикарбоновой кислоты[7]:
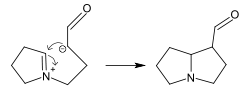
Другим примером являются различные методы аннелирования с использованием внутримолекулярной реакции Манниха, например, синтез пирролизидинового ядра[8]:
или синтез 1,2,3,4-тетрагидроизохинолинов по Пикте-Шпенглеру[9]:
Примечания
- ↑ Mannich, C.; W. Krösche (1912). «Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin». Archiv der Pharmazie 250 (1): 647-667. DOI:10.1002/ardp.19122500151. ISSN 1521-4184 0365-6233, 1521-4184. Проверено 2012-06-13.
- ↑ Daniel Lednicer and Charles R. Hauser. N,N-Dimethylaminomethylferrocene methiodide. Organic Syntheses, Coll. Vol. 5, p.434 (1973); Vol. 40, p.31 (1960).
- ↑ M. Betti. β-Naphthol phenylaminomethane. Organic Syntheses, Coll. Vol. 1, p.381 (1941); Vol. 9, p.60 (1929).
- ↑ Poppelsdorf, F.; S. J. Holt (1954-01-01). «Reactions of thiols and thioethers. Part I. An analogue of the Mannich reaction involving thiols, formaldehyde, and active methylene or methylidyne compounds». Journal of the Chemical Society (Resumed) (0): 1124-1130. DOI:10.1039/JR9540001124. ISSN 0368-1769. Проверено 2012-06-19.
- ↑ Crimmins, Michael T; J Lucas Zuccarello, J Michael Ellis, Patrick J McDougall, Pamela A Haile, Jonathan D Parrish, Kyle A Emmitte (2009-01-15). «Total synthesis of brevetoxin A». Organic letters 11 (2): 489-492. DOI:10.1021/ol802710u. ISSN 1523-7052. Проверено 2012-06-13.
- ↑ Nicolaou, K. C.; F. P. J. T. Rutjes, E. A. Theodorakis, J. Tiebes, M. Sato, E. Untersteller (1995). «Total Synthesis of Brevetoxin B. 2. Completion». J. Am. Chem. Soc. 117 (3): 1173-1174. DOI:10.1021/ja00108a052. ISSN 0002-7863.
- ↑ Robinson, Robert (1917). «LXIII. A synthesis of tropinone». Journal of the Chemical Society, Transactions 111: 762. DOI:10.1039/ct9171100762. ISSN 0368-1645. Проверено 2012-06-19.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 305.
- ↑ Whaley, W. M.; Govindachari, T. R. (1951). «The Pictet-Spengler synthesis of tetrahydroisoquinolines and related compounds». Org. React. 6: 74.
 Категория:
Категория:- Именные реакции в органической химии
- (CH3)2NCH2N(CH3)2 + 2 CF3COOH
Wikimedia Foundation. 2010.