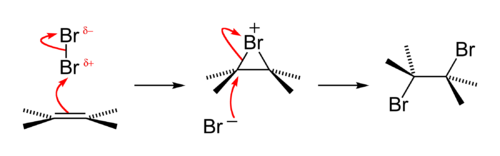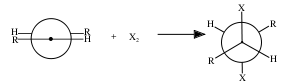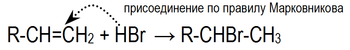- Реакции электрофильного присоединения
-
Реакции электрофильного присоединения (англ. addition electrophilic reaction) — реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил — частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся карбкатион подвергается нуклеофильной атаке.
В органической химии чаще всего атакующей электрофильной частицей является протон H+.
Несмотря на общность механизма различают реакции присоединения по связи углерод—углерод и углерод—гетероатом.
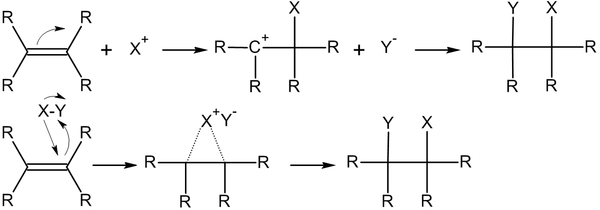
Общий вид реакций присоединения по двойной связи углерод-углерод:


Реакции электрофильного присоединения распространены среди алкенов и алкинов и широко используются в промышленном химическом производстве и лабораторных синтезах.Содержание
Реакции электрофильного присоединения по связи углерод-углерод
Механизм реакций электрофильного присоединения по связи углерод-углерод
Электрофильное присоединение по кратной связи обычно, двухстадийный процесс AdE2 — реакция бимолекулярного электрофильного присоединения (англ. addition electrophilic bimolecular). На первом этапе происходит атака электрофила и образование π-комплекса, который затем расщепляется, а далее образовавшийся карбкатион подвергается нуклеофильной атаке[1]:
Обычно, скорость лимитирующей является первая стадия реакции, хотя встречаются редкие исключения[2].
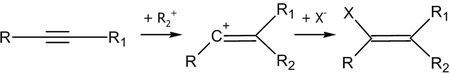
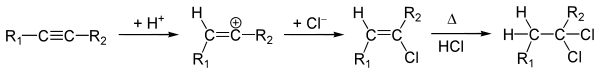
Аналогично происходит присоединение к алкинам:
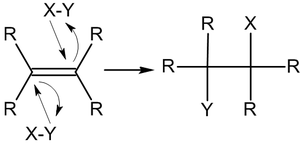
Реже встречается механизм AdE3 — реакция тримолекулярного электрофильного присоединения с одновременной атакой трех частиц[2]:
Реакции электрофильного присоединения более характерны для непредельных соединений, чем нуклеофильного, что объясняется пространственной доступностью π-электронов двойной связи электронодефицитных атакующих частиц X+[1].
Как и в реакциях ароматического электрофильного замещения, электронодонорные заместители повышают реакционную способность субстрата, а электроноакцепторные её снижают[2].
Присоединение галогенов
Присоединение галогенов по механизму AdE2 является едва ли не самой распространенной реакцией подобного рода. На первом этапе образуется π-комплекс, который в дальнейшем преобразуется в σ-комплекс и далее в дигалогенпроизводное[3]:
Присоединение брома — анти-присоединение, то есть присоединение с противоположной стороны, относительно плоскости молекулы алкена[3]. Это весьма наглядно представляется с помощью формул Ньюмена.
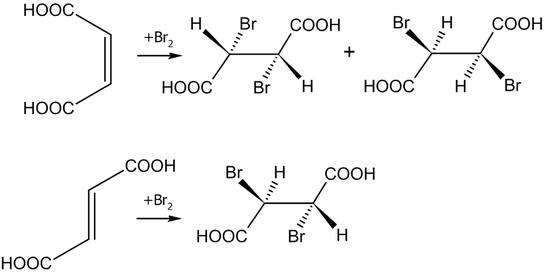
Подтверждение данного механизма обнаруживается при исследовании бромирования малеиновой и фумаровой кислот.
В первом случае образуется смесь энантиомеров, во втором — только один продукт:
Кинетика реакции бромирования обычно довольно сложна[3]:
Скорость реакции = k1*[RRC=CRR]*[Br2]+k2*[RRC=CRR]*[Br2]²+k3*[RRC=CRR]*[Br2]*[Br-] Хлорирование чаще дает более простую зависимость [4]:
Скорость реакции = k1*[RRC=CRR]*[Cl2] Присоединение галогеноводородов
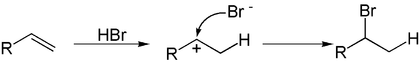
В отсутствии свободных радикалов* присоединение галогеноводородов подчиняется правилу Марковникова:
* Возможность проведения присоединения по свободнорадикальному механизму реализуется только для HBr и в редких случаях для HCl[2]
Стереохимически присоединение галогеноводородов к алкенам, обычно — анти-присоединение[4]. К син-присоединению склонны стирол, инден, аценафтилен и их производные[3].Алкины способны присоединить две молекулы галогеноводорода:
Другие типичные реакции электрофильного присоединения
1. Гидратация.

2. Присоединение спирта с образованием простого эфира.


3. Присоединение хлорноватистой кислоты с образованием хлоргидринов.

4. Присоединение хлорангидридов и/или карбоновых кислот.



5. Присоединение аммиака и/или аминов.



6. Карбонилирование.


 .
.Реакции электрофильного присоединения по связи углерод-гетероатом
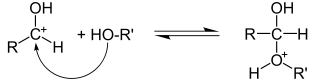
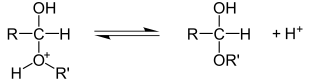
Механизм реакций электрофильного присоединения по связи углерод-гетероатом
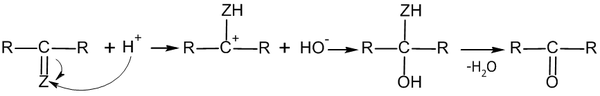
Электрофильное присоединение по кратной связи углерод-гетероатом имеет механизм AdE2:
Иногда продукты присоединения вступают в реакцию отщепления, тем самым совокупно давая реакцию замещения:
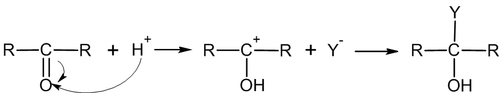
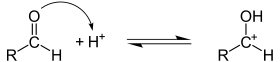
Связи углерод-гетероатом очень полярны, при этом на углероде формируется положительный заряд, а на гетероатоме — отрицательный. Соответственно, перовначальная атака может идти как по атому углерода (электрофильная атака), так и по гетероатому (нуклеофильная атака). В подавляющем большинстве случаев реакции присоединения по по кратной связи углерод-гетероатом носят нуклеофильный характер[2].
Типичные реакции электрофильного присоединения по связи C=O
1. Присоединение спиртов.
2. Присоединение нитрилов к альдегидам.

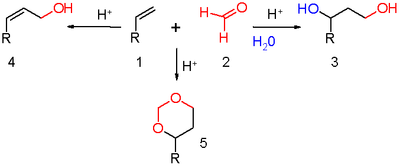
3. Реакция Принса.
Типичные реакции электрофильного присоединения по связи C=N и С≡N
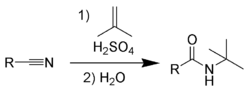
1. Реакция Риттера.
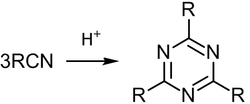
2. Тримеризация нитрилов.
3. Гидролиз нитрилов и изонитрилов.


4. Алкоголиз нитрилов.

Примечания
- ↑ 1 2 Сайкс П. Механизмы реакций в органической химии, 4-е изд. / Пер. с англ.,под редакцией В. Ф. Травеня — M.: Химия, 1991 — ISBN 5-7245-0191-0
- ↑ 1 2 3 4 5 Mарч Дж. Органическая химия, пер. с англ., т. 3, — M.: Мир, 1988
- ↑ 1 2 3 4 Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- ↑ 1 2 Керри Ф, Сандберг Р. Углубленный курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.
Химические реакции в органической химии Реакции замещения Реакции нуклеофильного замещения · Реакции электрофильного замещения · Реакции радикального замещения Реакции присоединения Реакции нуклеофильного присоединения · Реакции электрофильного присоединения · Реакции радикального присоединения · Реакции синхронного присоединения Реакции элиминирования Реакции гетеролитического элиминирования · Реакции перициклического элиминирования · Реакции радикального элиминирования Реакции перегруппировки Нуклеофильные перегруппировки · Электрофильные перегруппировки · Радикальные перегруппировки Реакции окисления и восстановления Реакции окисления · Реакции восстановления Прочее Именные реакции в органической химии Категории:- Химические реакции
- Реакции в органической химии
- Реакции присоединения
Wikimedia Foundation. 2010.