- Реакции электрофильного замещения
-
Реакции электрофильного замещения (англ. substitution electrophilic reaction) — реакции замещения, в которых атаку осуществляет электрофил — частица, заряженная положительно или имеющая дефицит электронов. При образовании новой связи уходящая частица — электрофуг отщепляется без своей электронной пары. Самой популярной уходящей группой является протон H+.
Все электрофилы являются кислотами Льюиса.
Общий вид реакций электрофильного замещения:
 (катионный электрофил)
(катионный электрофил) (нейтральный электрофил)
(нейтральный электрофил)Выделяют реакции ароматического (широко распространены) и алифатического (мало распространены) электрофильного замещения. Характерность реакций электрофильного замещения именно для ароматических систем объясняется высокой электронной плотностью ароматического кольца, способного притягивать положительно заряженные частицы.
Реакции ароматического электрофильного замещения играют крайне важную роль в органическом синтезе и широко используются как в лабораторной практике, так и промышленности.
Содержание
Реакции ароматического электрофильного замещения
Для ароматических систем фактически существует один механизм электрофильного замещения — SEAr. Механизм SE1 (по аналогии с механизмом SN1) — встречается крайне редко, а SE2 (соответствующий по аналогии SN2) — не встречается вовсе[1].
Реакции SEAr
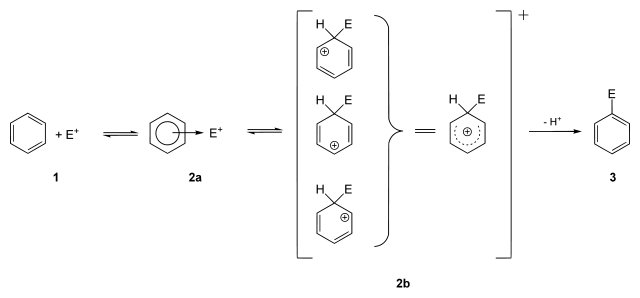
Механизм реакции SEAr или реакции ароматического электрофильного замещения (англ. Electrophilic aromatic substitution) является самым распространенным и наиболее важным среди реакций замещения ароматических соединений и состоит из двух стадий. На первом этапе происходит присоединение электрофила, на втором — отщепление электрофуга:
В ходе реакции образуется промежуточный положительно заряженный интермедиат (на рисунке — 2b). Он носит название интермедиат Уэланда, арониевый ион или σ-комплекс. Этот комплекс, как правило, очень реакционноспособен и легко стабилизируется, быстро отщепляя катион.
Лимитирующей стадией в подавляющем большинстве реакций SEAr является первый этап.
Скорость реакции SEAr, обычно, представляется в следующем виде[2]:
Скорость реакции = k*[ArX]*[E+] В качестве атакующей частицы обычно выступают относительно слабые электрофилы, поэтому в большинстве случаев реакция SEAr протекает под действием катализатора — кислоты Льюиса. Чаще других используются AlCl3, FeCl3, FeBr3, ZnCl2.
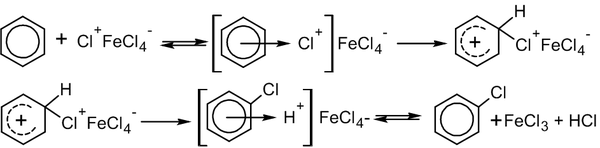
В этом случае механизм реакции выглядит следующим образом (на примере хлорирования бензола, катализатор FeCl3)[3]:
1.На первом этапе катализатор взаимодействует с атакующей частицей с образованием активного электрофильного агента:

2. На втором этапе, собственно, и реализуется механизм SEAr:
Типовые реакции ароматического электрофильного замещения
1. Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений:

Образование активной частицы[2]:

Скорость реакции = k*[ArH]*[NO2+] 2. Сульфирование бензола с получением сульфокислоты:

Активной частицей в реакции является SO3.
3. Галогенирование бензола бромом, хлором или йодом приводит к образованию арилгалогенидов. Катализатором реакции выступает галогенид железа (III):

Образование активной частицы[2]:

Скорость реакции = k*[ArH]*[X2]*[FeX3] 4. Реакция Фриделя-Крафтса — ацилирование или алкилирование с использованием ацил- или алкилгалогенидов. Типичным катализатором реакции служит хлорид алюминия, но может использоваться любая другая сильная кислота Льюиса.

Скорость реакции = k*[ArH]*[RX]*[AlCl3] Реакционная способность и ориентация в производных бензола
Заместители в бензольном кольце могут как способствовать реакции замещения (активирующие заместители), так и замедлять скорость реакции (дезактвирующие заместители). Некоторые группы ориентируют замещение в орто- и пара- положения, другие — в мета.
Влияние различных групп на реакционную способность объясняется устойчивостью, иначе говоря энергией активации, требующейся для получения трех возможных промежуточных интермедиатов[1].
Реакционная способность и ориентация различных групп в производных бензола[1][4]:
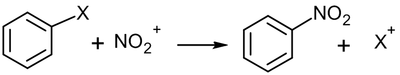
Положение Сильноактивирующие заместители Активирующие заместители Дезактивирующие заместители Сильно дезактивирующие заместители орто- и пара- замещение OH, NH2, NHR, NRR' Ar, R, OR, NHCOR, OCOR, SR Cl, Br, I нет мета- замещение нет нет CHO, COR, COOH, COOR, CCl3 NO2, CN, NH3+ В замещенных бензолах возможна так называемая ипсо-атака, то есть замещение имеющегося заместителя на другой:
Реакции алифатического электрофильного замещения
Реакции SE1
Механизм реакции SE1 или реакции мономолекулярного электрофильного замещения (англ. substitution electrophilic unimolecular) аналогичен механизму SN1 включает следующие стадии:
1. Ионизация субстрата с образованием карбаниона (медленная стадия):

2. Электрофильная атака карбаниона (быстрая стадия):

Чаще всего уходящей частицей в крайне редких реакциях SE1 является протон.
Реакции SE2
Механизм реакции SE2 или реакции бимолекулярного электрофильного замещения (англ. substitution electrophilic bimolecular ) аналогичен механизму SN2, происходит в одну стадию, без промежуточного образования интермедиата:
![\mathsf{R\!\!-\!\!X + Y^+}\rightarrow\mathsf{[Y}\cdot\cdot\cdot\mathsf{R}\cdot\cdot\cdot\mathsf{X]}\rightarrow\mathsf{R\!\!-\!\!Y + X^+}](d5455ed7876ac448fc3a8ce58606a4a6.png)
Главное отличие от нуклеофильного механизма заключается в том, что атака электрофила может осуществляться как с фронта, так и с тыла, что в результате может привести к различному стереохимическому результату: как рацемизации, так и инверсии[1].
Примером может служить реакция кетонно-енольной таутомеризации:
Примечания
- ↑ 1 2 3 4 Mарч Дж. Органическая химия, пер. с англ., т. 2, — M.: Мир, 1988
- ↑ 1 2 3 Сайкс П. Механизмы реакций в органической химии, 4-е изд. / Пер. с англ.,под редакцией В. Ф. Травеня — M.: Химия, 1991 — ISBN 5-7245-0191-0
- ↑ Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- ↑ Керри Ф, Сандберг Р. Углубленный курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.
Химические реакции в органической химии Реакции замещения Реакции нуклеофильного замещения · Реакции электрофильного замещения · Реакции радикального замещения Реакции присоединения Реакции нуклеофильного присоединения · Реакции электрофильного присоединения · Реакции радикального присоединения · Реакции синхронного присоединения Реакции элиминирования Реакции гетеролитического элиминирования · Реакции перициклического элиминирования · Реакции радикального элиминирования Реакции перегруппировки Нуклеофильные перегруппировки · Электрофильные перегруппировки · Радикальные перегруппировки Реакции окисления и восстановления Реакции окисления · Реакции восстановления Прочее Именные реакции в органической химии Категории:- Химические реакции
- Реакции в органической химии
- Реакции замещения
Wikimedia Foundation. 2010.