Oxydation de Jones
(Redirigé depuis Oxydation de jones)
L'oxydation de Jones est une réaction chimique décrite comme étant l'oxydation par l'acide chromique des alcools primaires en acides carboxyliques et des alcools secondaires en cétones[1],[2],[3],[4],[5].
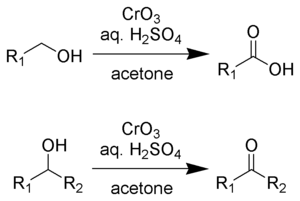
Le réactif de Jones, une solution de trioxyde de chrome dans de l'acide sulfurique concentré, est employé comme agent oxydant.
- L'acétone affecte sensiblement les propriétés de l'acide chromique.
- L'oxydation est très rapide, relativement exothermique, et les rendements sont généralement élevés.
- Le réactif oxyde rarement les liaisons insaturées.
- Les résidus chromés sont très toxiques, si bien que la prudence doit être de rigueur lors de l'utilisation de cette réaction.
La première demi-équation chimique de la réaction est : 2 CrO3 + 3 H2SO4 + 6 H+ + 6 e- → Cr2(SO4)3 + 6 H2O
La deuxième demi-équation chimique de la réaction est : 3 R2HC-OH → 3 R2C=O + 6 H+ + 6 e-
Références[modifier | modifier le code]
- Bowden, K.; Heilbron, I. M.; Jones, E. R. H. J. Chem. Soc. 1946, 39.
- Heilbron, I.M.; Jones, E.R.H.; Sondheimer, F. J. Chem. Soc. 1949, 604.
- Bladon, P. et al. J. Chem. Soc. 1951, 2402.
- Jones, E. R. H. et al. J. Chem. Soc. 1953, 457 & 2548 & 3019.
- Djerassi, C. et al. J. Org. Chem. 1956, 21, 1547.
