Alcène

Les alcènes sont des hydrocarbures insaturés, caractérisés par la présence d'au moins une double liaison covalente entre deux atomes de carbone. Ces liaisons sont toujours de types covalentes normales parfaites. Les alcènes non cycliques n'ayant qu'une double liaison possèdent une formule brute de la forme CnH2n où n est un entier naturel supérieur ou égal à 2. L'alcène le plus simple est l'éthylène (nom usuel de l'éthène).
Le terme « oléfine » était le nom donné par le passé aux alcènes ; bien qu'encore employé (ainsi que le terme « polyoléfine »), il tombe progressivement en désuétude.
Nomenclature[modifier | modifier le code]
Nombre de doubles liaisons[modifier | modifier le code]
Les alcènes ne comportant qu'une double liaison sont des monoalcènes, les autres sont des polyènes : diènes (2 doubles liaisons), triènes (3), tétraènes (4), etc.
Alcènes non ramifiés[modifier | modifier le code]
Il faut utiliser le même nom que celui de l'alcane portant le même nombre d'atomes de carbone, en utilisant le suffixe « -ène » à la place de « -ane » et en intercalant l'indice de position de la double liaison (voir règle 2a) dans le mot, avant le suffixe, et encadré par deux tirets.
Si l'alcène non ramifié n'a pas sa double liaison en première position, alors il faut préciser s'il s'agit d'un alcène E (si les deux atomes H portés par la double liaison sont opposés) ou Z dans le cas contraire. C'est le cas du pent-2-ène, par exemple.
Alcènes ramifiés[modifier | modifier le code]
Voici les règles à suivre pour nommer un alcène ramifié :
Règle 1
Dans la formule de structure, déterminer la chaîne carbonée principale (c'est-à-dire la chaîne la plus longue d'éléments contenant un C) comportant obligatoirement la double liaison.
En pratique, cela revient à :
- choisir une extrémité de la chaîne carbonée ;
- parcourir la chaîne en passant par le plus grand nombre d'atomes C consécutifs.
Règle 2
- Afin de situer la double liaison, numéroter la chaîne principale de façon que le numéro de l'atome C portant la double liaison soit le plus petit possible.
- Suivre la même numérotation pour situer les ramifications.
Règle 3
- Citer le nom de la ramification alkyle, suivi de son indice de position entouré de tirets. Faire suivre du nom de l'alcène comme s'il n'était pas ramifié.
La stéréochimie de la double liaison peut être déterminée selon les règles de priorité de Cahn-Ingold-Prelog :
- si les groupes les plus importants liés à chacun des atomes de carbone de la double liaison se retrouvent du même côté par rapport à la double liaison, l'isomère a la stéréochimie Z (de l'allemand zusammen, ensemble), exemple :
- si les groupes les plus importants liés à chacun des atomes de carbone de la double liaison se retrouvent de côté opposé par rapport à la double liaison, l'isomère a la stéréochimie E (de l'allemand entgegen, opposé), exemple :
Propriétés physiques[modifier | modifier le code]
Les alcènes ont des températures d'ébullition un peu plus basses que celles des alcanes correspondants car les forces de van der Waals sont plus faibles ; en effet, une double liaison prend plus d'espace qu'une simple liaison, donc les molécules s'empilent de façon moins compacte et les forces intermoléculaires sont moins importantes. Il en résulte qu'il faut fournir moins d'énergie pour les rompre : les températures d'ébullition sont plus basses. Ils brûlent avec une flamme claire.
À température et pression ambiantes, les alcènes sont gazeux jusqu'au butène, puis liquides et enfin solides à partir de C16. Leur solubilité, médiocre dans l'eau, est bonne dans l'alcool et l'éther.
Réactivité[modifier | modifier le code]
La double liaison est formée d'une liaison σ (sigma) forte (EL = 347 kJ/mol) et d'une liaison π (pi), appelée également liaison insaturée, plus faible (EL = 263 kJ/mol).
La force de la liaison π étant plus faible que celle de la liaison σ, elle cède plus facilement.
Les principales réactions des alcènes sont :
- réaction d'addition sur les carbones porteurs de la double liaison ;
- réaction de destruction et de dégradation.
Bien que les réactions suivantes commencent formellement comme des additions, il est d'usage de les considérer à part :
- réaction de coupure de la double liaison (sans destruction de la molécule) comme l'ozonolyse ou la métathèse ;
- réaction de polymérisation ;
- la présence d'une double liaison (ou de plusieurs doubles liaison conjuguées) active l'hydrogène en alpha de la double liaison.
Réaction d'addition[modifier | modifier le code]
Lors des réactions, la liaison π peut se rompre : un réactif A-B électrophile va s'additionner sur la double liaison de l'alcène et il y a formation d'un produit saturé. La liaison π a donc été remplacée par deux liaisons σ.
Action du dihydrogène[modifier | modifier le code]
L'addition du dihydrogène sur un alcène donne un alcane : CnH2n + H2 → CnH2n+2

Cette réaction utilisera un mécanisme de cis-addition.
Action d'un dérivé halogéné[modifier | modifier le code]
Formation du produit Markovnikov[modifier | modifier le code]
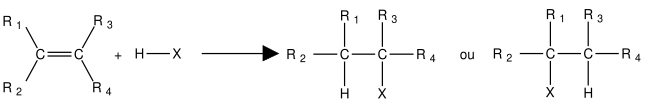
Cette réaction obéit à la règle de Markovnikov : dans une réaction d'addition de H-X sur un alcène, en l'absence de peroxyde et dans l'obscurité, l'atome d'hydrogène migre vers le carbone moins substitué (c'est-à-dire le plus hydrogéné, pour former le carbocation le plus stable).
Formation du produit Kharasch ou anti-Markovnikov[modifier | modifier le code]
Exemple : addition radicalaire du bromure d'hydrogène sur le 3-méthylhex-3-ène en présence de peroxyde de benzoyle.
Le mécanisme réactionnel est séparable en trois étapes :
- amorçage :
un peroxyde est un bon amorceur radicalaire, il se coupe spontanément en deux radicaux, qui, à leur tour, attaquent une molécule de HBr pour former le radical de propagation Br• . L'amorçage peut aussi être réalisé par irradiation aux UV ;
- propagation :
c'est dans l'étape de propagation que se forme le produit final, le 4-bromo-3-méthylhexane ;
- terminaison :
dans cette étape, M est une molécule quelconque du mélange réactionnel, voire une molécule du récipient, elle absorbe l'énergie issue du regroupement de deux radicaux.
Cette réaction, en présence de peroxyde ou d'UV, donne au dérivé halogéné une orientation inverse de celle observée en l'absence de ces réactifs ; on parle d'orientation anti-Markovnikov, ou d'« effet Kharasch ».
Action d'un halogène[modifier | modifier le code]
→ Halogénation : addition de H-X.
→ Dihalogénation : addition de dichlore ou dibrome (diiode trop peu réactif, difluor trop réactif).
Action de l'eau (hydratation) en milieu acide[modifier | modifier le code]
Un alcène ne réagit pas avec l’eau. On rend alors le milieu acide en ajoutant par exemple de l'acide sulfurique H2SO4 Cette réaction obéit à la règle de Markovnikov : dans une réaction d'addition de H2O sur un alcène, en l'absence de peroxyde, l'atome d'hydrogène migre vers le carbone le moins substitué (c'est-à-dire le plus hydrogéné).
Action d'un oxydant faible[modifier | modifier le code]
Ces réactions d'addition syn, désignées comme réactions de « dihydroxylation » parce qu'elles fixent un radical hydroxyl sur chacun des carbones de la double liaison, doivent être catalysées.

Sur le plan théorique, on peut utiliser comme oxydant :
- l'ion permanganate en milieu neutre : la réaction sur l'alcène conduit alors à un diol ; cependant, MnO4− reste un oxydant trop fort : s'il a été trop chauffé, il dégrade le diol en acide gras.
- On lui préfère donc en général, pour la synthèse de diols, le tétroxyde d'osmium, mais en petite quantité du fait de son extrême toxicité. De ce fait, on utilise de l'eau oxygénée (H2O2) qui le reforme après réaction (il tient donc le rôle de catalyseur).
Action d'une solution d'oxydant fort[modifier | modifier le code]
(ozonolyse par exemple)
Si R2 est un atome d'hydrogène, alors R1CH=O est un aldéhyde. Néanmoins l'aldéhyde est oxydée en un acide carboxylique par l'ozone présent dans le milieu ; si on désire conserver l'aldéhyde, il est nécessaire d'utiliser un réducteur (le zinc par exemple).
Si R1 et R2 sont des groupes alkyles, alors R1R2C=O est une cétone.
La même réaction est possible avec le permanganate, chauffé en milieu acide. La différence avec l'ozone est que dans le cas de formation d'un aldéhyde, on ne peut empêcher sa transformation en acide carboxylique.
Hydroboration[modifier | modifier le code]
Permet l'obtention de certains alcools primaires, là où l'addition d'eau conduit à un alcool secondaire, par exemple l'hydroboration du but-1-ène conduit au butan-1-ol, alors qu'une l'hydratation donne du butan-2-ol.
Formation d'époxydes, obtention d'un diol[modifier | modifier le code]
Un alcène mis en présence de dioxygène conduit à un époxyde. Il est nécessaire de chauffer en présence d'un catalyseur, l'argent par exemple.
En industrie, on utilise des peracides (RCO-O-O-H), dont la liaison peroxyde est très oxydante, le plus utilisé étant le MCPBA (acide méta-chloroperbenzoïque).
L'hydratation (réaction d'addition) d'un époxyde conduit à un diol.
Réaction de destruction par combustion[modifier | modifier le code]
Réaction de Diels-Alder[modifier | modifier le code]
La réaction de Diels-Alder est un cas particulier des cycloadditions entre systèmes π. Il s'agit d'une réaction d'addition entre un diène conjugué (les deux doubles liaisons sont séparées par une liaison simple) et un alcène (diénophile). L'exemple-type de cette réaction est la réaction entre le buta-1,3-diène et l'éthylène pour former le cyclohexène :