Intoxication à l'éthylène glycol
L’intoxication à l'éthylène glycol est provoquée par l’ingestion de ce composé. Les cas d'intoxication des animaux domestiques[1] et des enfants sont très loin d'être rares. En effet son goût sucré attire et ce produit est assez courant.
L’éthylène glycol est le plus souvent rencontré dans l’industrie automobile et le chauffage comme principal ingrédient d’antigels et de liquides de frein. Il s’agit d’un liquide non volatil extrêmement toxique, incolore, inodore, avec un goût sucré. Après l’ingestion, les symptômes de l’intoxication suivent une progression en trois étapes après l’intoxication et les vomissements, d’abord l’acidose métabolique, puis les troubles cardiovasculaires et enfin l’insuffisance rénale aiguë. La principale cause de sa toxicité n’est pas due à l’éthylène glycol lui-même, mais aux métabolites de l’éthylène glycol après qu’il a été métabolisé. Les métabolites principaux responsables de sa toxicité sont l’acide glycolique et l’acide oxalique.
La méthode de diagnostic médical de l'intoxication considérée comme la plus fiable est la mesure de l'éthylène glycol dans le sang. Cependant, de nombreux hôpitaux ne disposent pas des équipements nécessaires pour effectuer ce test et ont besoin de s'appuyer sur des anomalies biochimiques de l’organisme pour diagnostiquer l'intoxication. Le diagnostic peut aussi être aidé par l'examen d'urine avec la présence de cristaux d'oxalate de calcium. Le traitement consiste d'abord à stabiliser le patient par le recours à des antidotes. Les antidotes utilisés sont l’éthanol ou le fomépizole. Les antidotes agissent en bloquant l’enzyme responsable du métabolisme de l'éthylène glycol et donc, en arrêtant la progression de l'intoxication. L’hémodialyse est aussi utilisée pour aider à l’élimination de l'éthylène glycol et de ses métabolites présents dans le sang. Lorsque le traitement médical est entrepris, le pronostic est généralement bon et la plupart des patients se rétablissent complètement. L’intoxication est relativement répandue et en raison de son goût sucré, les enfants et les animaux consomment parfois de grandes quantités d'éthylène glycol. Le benzoate de dénatonium, un produit amer, est ajouté à de nombreux produits antigels pour tenter d'éviter leur ingestion.

Toxicité[modifier | modifier le code]
On a d’abord cru que l'éthylène glycol était inoffensif, en 1931 on a suggéré de l’utiliser comme véhicule ou solvant pour des préparations pharmaceutiques injectables[2]. De nombreux cas d'intoxication ont été signalés depuis et il s’est révélé très toxique pour l'homme[3]. La dose toxique nécessitant un traitement médical est difficile à déterminer, mais on la situe habituellement à 0,1 ml de substance pure par kg de poids corporel (ml / kg). Les centres antipoison considèrent souvent qu’au-dessus d’une lampée pour un enfant ou d’une gorgée pour un adulte, il est nécessaire d'évaluer la dose à l'hôpital[4]. On estime la dose létale par voie orale pour l'homme à environ 1,4 ml / kg d'éthylène glycol[5]. Bien qu’avec un traitement médical on ait observé une survie avec des doses beaucoup plus élevées, la mort survient avec seulement 30 ml de produit concentré chez l’adulte[6],[7],[8].
L'éthylène glycol a une faible pression de vapeur, il ne peut donc pas s’évaporer facilement dans des conditions normales de température et, par conséquent, l'intoxication est peu susceptible de se produire après exposition par inhalation de fortes concentrations dans l'atmosphère[9]. Il peut exister un léger risque d'intoxication en cas de génération de vapeurs ou de brouillards, bien que cela mène rarement à un empoisonnement parce que l'éthylène glycol provoque des irritations et de la toux lorsqu’il est inhalé, alertant les victimes potentielles de sa présence[10]. L'éthylène glycol n’est pas bien absorbé à travers la peau et un empoisonnement suivant une exposition cutanée est également rare[11].
Signes et symptômes[modifier | modifier le code]
Les symptômes de l'intoxication par l'éthylène glycol suivent généralement une progression en trois étapes, bien que les personnes intoxiquées puissent ne pas développer toujours chaque étape[5].
- Étape 1 (de 0,5 à 12 heures).Elle se compose de symptômes neurologiques et gastro-intestinaux; les victimes peuvent paraître ivres, présentant des symptômes tels que des vertiges, une incoordination des mouvements musculaires, un nystagmus, des céphalées, des troubles de l'élocution et de la confusion. L’irritation de l'estomac peut provoquer des nausées et des vomissements[5]. Au bout d’un certain temps, le corps métabolise l'éthylène glycol pour produire d'autres substances toxiques.
- Étape 2 (12 à 36 heures). Elle est le résultat de l'accumulation d’acides organiques produits par le métabolisme de l'éthylène glycol et se manifeste par une accélération du rythme cardiaque, une hypertension, une hyperventilation et une acidose métabolique. En outre une chute du taux de calcium dans le sang, une exagération des réflexes musculaires, des spasmes musculaires, un allongement de l’intervalle QT, et une insuffisance cardiaque peuvent se produire. En l’absence de traitement, la mort survient le plus souvent au cours de cette période[5].
- Étape 3 (24 à 72 heures) de l’intoxication par l'éthylène glycol. Elle est le résultat de l’atteinte rénale. Les symptômes comprennent la nécrose tubulaire aiguë, l’hématurie (présence de globules rouges dans les urines), la protéinurie (présence d’albumine dans les urines), douleur lombaires, l’oligurie (diminution de la production d’urine), l’anurie (absence de production d'urine), l’hyperkaliémie (niveau élevé de potassium dans le sang) et l'insuffisance rénale aiguë[12],[13]. Si l'insuffisance rénale survient, elle est généralement réversible, bien que des semaines ou des mois de soins, y compris par hémodialyse puissent être nécessaires avant la récupération de la fonction rénale[5].
Physiopathologie[modifier | modifier le code]

Les trois principaux systèmes affectés par l'intoxication à l'éthylène glycol sont le système nerveux central, les voies métaboliques et les reins[5]. Le système nerveux central est le premier touché au cours de l'intoxication par effet toxique direct de l'éthylène glycol. De la même manière que l’éthanol, il provoque une intoxication, suivi de somnolence ou de coma[5]. Des convulsions peuvent se produire en raison d'un effet toxique direct du produit[12]. Le mécanisme de l’intoxication par l'éthylène glycol est principalement lié à l’action des métabolites de l'éthylène glycol. Au départ, il est métabolisé par l’alcool déshydrogénase en glycolaldéhyde qui est alors oxydé en acide glycolique. L'élévation des métabolites peut provoquer une encéphalopathie ou un œdème cérébral[14]. Les effets métaboliques se produisent 12 à 36 heures après l'ingestion, ce qui provoque principalement une acidose métabolique, principalement due à l’accumulation d'acide glycolique. En outre, comme effet secondaire des deux premières étapes du métabolisme, il se produit une augmentation de la concentration sanguine d’acide lactique contribuant à l’acidose lactique. La formation de métabolites acides provoque également l'inhibition de l'autre voie métabolique, comme la phosphorylation oxydative[5].
L’atteinte rénale par l'éthylène glycol se produit 24 à 72 heures après l'ingestion et est provoquée par un effet cytotoxique de l'acide glycolique. L'acide glycolique est ensuite métabolisé en acide glyoxylique et, enfin, en acide oxalique. L'acide oxalique se lie au calcium pour former des cristaux d'oxalate de calcium qui peuvent se déposer et causer des dommages dans de nombreuses régions du corps, y compris le cerveau, le cœur, les reins et les poumons[5]. L'effet le plus significatif est l'accumulation de cristaux d’oxalate de calcium dans les reins qui provoque des lésions rénales conduisant à l’oligurie ou l’anurie et l’insuffisance rénale aiguë[5]. Le facteur de limitation dans cette cascade est la conversion d’acide glyoxylique en acide glycolique[15]. L'accumulation d'acide glycolique dans le corps est le principal facteur responsable de la toxicité du produit[16].
Diagnostic[modifier | modifier le code]
Comme les signes cliniques et les symptômes de l'intoxication par l'éthylène glycol ne sont, pour la plupart, pas spécifiques et se produisent dans de nombreuses autres intoxications, le diagnostic est souvent difficile[17]. Le moyen diagnostique le plus fiable est la mesure du taux sanguin d'éthylène glycol. L'éthylène glycol peut facilement être dosé dans les liquides biologiques par chromatographie en phase gazeuse[18]. De nombreux laboratoires hospitaliers n'ont pas la capacité de réaliser ces dosages sanguins et en l'absence de ce test, le diagnostic doit être basé sur l’aspect clinique du patient[5]. Dans cette situation, un examen utile pour le diagnostic de l'intoxication est la mesure du trou osmolaire. L’osmolalité du sérum des patients est mesurée par l’abaissement du point de congélation et ensuite par sa comparaison avec l'osmolarité prédite sur la base de la mesure chez les patients du taux de sodium, de glucose, d’urée et la quantité d’éthanol qui peut avoir été ingérée. La présence d'un grand trou osmolaire conforte le diagnostic d'intoxication à l'éthylène glycol. Toutefois, un trou osmolaire normal n'exclut pas l’exposition à l'éthylène glycol du fait d’une grande variabilité individuelle[19],[20].
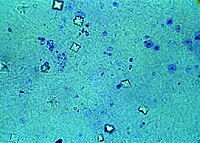
L’agrandissement du trou osmolaire est provoqué par l'éthylène glycol lui-même. Au fur et à mesure que la dégradation métabolique de l'éthylène glycol progresse, le taux d'éthylène glycol diminue dans le sang et la mesure du trou osmolaire est moins utile[21]. En outre, la présence d'autres alcools tels que l’éthanol, l’isopropanol, ou le méthanol ou des troubles tels que l’acidocétose, l’acidocétose diabétique, ou l’acidose lactique, ou encore l’insuffisance rénale peuvent également produire un trou osmolaire important conduisant à un mauvais diagnostic[5].
D'autres anomalies des examens de laboratoire peuvent suggérer une intoxication, en particulier la présence d'une acidose métabolique, notamment si elle se caractérise par un grand trou anionique. Cette acidose avec trou anionique est généralement présente dans la phase initiale de l'intoxication. Toutefois, il existe un grand nombre de diagnostics différentiels de l'acidose, y compris l'intoxication au méthanol, à l’acide salicylique, par le fer, l’isoniazide, le paracétamol, la théophylline, ou des troubles tels que l’urémie et l’acidocétose diabétique ou alcoolique. Le diagnostic d'intoxication par l'éthylène glycol doit être évoquée chez le patient présentant une forte acidose[5]. L’examen au microscope des urines peut révéler des cristaux d'oxalate de calcium en forme d’aiguilles ou d'enveloppe qui peuvent orienter vers le diagnostic, même si ces cristaux peuvent être absents jusqu'à la dernière étape de l'intoxication[22]. Enfin, de la fluorescéine a été ajoutée à de nombreux produits antigels pour permettre aux fuites de radiateur d'être détectées au moyen d’une lampe de Wood. Après l'ingestion de produits antigels contenant de l'éthylène glycol et de la fluorescéine, une lampe de Wood peut révéler une fluorescence de la bouche d'un patient, de ses vêtements, des vomissements, ou des urines qui peut aider au diagnostic de l’intoxication[23],[24].
Traitement[modifier | modifier le code]
Le traitement initial consiste à stabiliser le patient et à procéder à l’élimination du produit contenu dans l’estomac. Du fait que l'éthylène glycol est rapidement absorbé, la décontamination gastrique doit être effectuée peu de temps après l'ingestion pour être bénéfique. Le lavage gastrique ou l’aspiration par sonde nasale du contenu gastrique sont les méthodes les plus employées dans l’intoxication par l'éthylène glycol[5]. L'utilité d'un lavage gastrique a toutefois été remise en question et il n'est désormais plus utilisé en routine dans les situations d'intoxication[25].Il n'est pas recommandé de provoquer des vomissements par le sirop d'ipéca. Comme le charbon activé n’absorbe pas les glycols, son utilisation n'est pas recommandée car elle ne serait pas efficace pour empêcher l'absorption[5],[26]. Il est seulement utilisé en présence d’une dose toxique d’un autre produit ou médicament[19]. Les patients intoxiqués sont souvent dans un état critique. Dans cette situation la stabilisation du patient, notamment le contrôle des voies respiratoires par l’ intubation est le geste initial le plus important[5]. Les patients présentant une acidose métabolique ou des convulsions ont besoin respectivement de bicarbonate de sodium et d'un traitement anti-convulsivant comme les benzodiazépines[5]. Le bicarbonate de sodium doit être utilisé avec prudence car il peut aggraver une hypocalcémie en augmentant la liaison des protéines plasmatiques avec le calcium. Si elle survient, l’hypocalcémie peut être traitée par le calcium bien que la supplémentation en calcium comporte le risque d’augmenter la précipitation des cristaux d'oxalate de calcium conduisant à des lésions tissulaires[17].
Après la décontamination et l'institution de mesures de réanimation, la priorité suivante est l'inhibition du métabolisme de l'éthylène glycol en utilisant un antidote. Les antidotes de l'éthylène glycol sont l’éthanol ou le fomépizole. Cette forme de traitement antidote est la clef de voûte du contrôle de l’intoxication par l'éthylène glycol. L'éthanol n'est pas un inhibiteur de l'alcool déshydrogénase car l’ADH métabolise également l'éthanol. L'éthanol agit par compétition avec l'éthylène glycol auprès de l'alcool déshydrogénase. L'éthanol de qualité pharmaceutique est généralement administré par voie intraveineuse en solution à 5 ou 10 % dans un soluté de glucose à 5 %, mais il est également parfois donné par voie orale sous la forme d'une eau de vie comme le whisky, la vodka, ou le gin. L'alcool déshydrogénase a une affinité environ 100 fois plus forte pour l'éthanol que pour l'éthylène glycol, le traitement par l'éthanol sature l'enzyme en inhibant le métabolisme de l’éthylène glycol, limitant ainsi la formation de métabolites toxiques[5].
Le fomépizole est un puissant inhibiteur de l'alcool déshydrogénase, similaire à l'éthanol, il agit en bloquant la formation de métabolites toxiques[17],[27]. Il a été démontré que le fomépizole était un antidote très efficace de l’intoxication par l'éthylène glycol[27],[28]. Il est le seul antidote approuvé par la FDA des États-Unis pour le traitement de l'intoxication à l'éthylène glycol[5]. Les deux antidotes ont des avantages et des inconvénients. L'éthanol est facilement disponible dans la plupart des hôpitaux, peu coûteux, et peut être administré par voie orale ainsi que par voie intraveineuse. Ses effets néfastes sont l’intoxication, l’hypoglycémie chez l’enfant et une possible toxicité hépatique[19]. Les patients recevant le traitement par l’éthanol nécessitent également de fréquentes mesures du niveau d'éthanol dans le sang et l’ajustement des dosages pour maintenir une concentration efficace d'éthanol. Les patients doivent donc être suivis dans une unité de soins intensifs. À l’inverse, les effets indésirables du fomépizole sont minimes et le schéma posologique approuvé permet de maintenir des concentrations thérapeutiques sans avoir à surveiller le taux sanguin de la molécule. L'inconvénient du fomépizole est son prix élevé. Il coûte 1000 USD par gramme, le coût moyen d’un traitement utilisé pour l'intoxication d'un adulte est d’environ 3500 à 4000 $[29],[30]. Malgré son coût, le fomépizole remplace progressivement l'éthanol comme antidote de choix dans l’intoxication par l'éthylène glycol[27],[28]. L’adjonction d’agents, comme la thiamine et la pyridoxine est fondée sur le fait qu'ils peuvent aider à prévenir la formation d'acide oxalique[5]. L'emploi de ces agents est basée sur des observations théoriques et il existe peu de preuves à l'appui de leur usage en thérapeutique, leur usage pourrait être particulièrement bénéfique chez les personnes qui pourraient être carencés en vitamines de ce type, tels que les patients malnutris ou alcooliques[17].
En plus des antidotes, un traitement important de l'intoxication est l'emploi de l’hémodialyse. L'hémodialyse est utilisée pour améliorer l'élimination de l'organisme de l’éthylène glycol non-métabolisé, ainsi que ses métabolites. Il a été démontré que cette méthode était très efficace pour l'élimination de l'éthylène glycol et de ses métabolites contenus dans le sang[15],[31]. L’hémodialyse a également l'avantage de corriger les autres anomalies métaboliques ou de pallier la détérioration de la fonction rénale. L'hémodialyse est généralement indiquée chez les patients atteints d'acidose métabolique sévère (pH sanguin inférieur à 7,3), d'insuffisance rénale sévère, de déséquilibre électrolytique, ou les patients dont l'état se détériore malgré le traitement[17],[12]. Le traitement antidote et l'hémodialyse sont souvent utilisés ensemble dans le traitement de l'intoxication. Du fait que l'hémodialyse va également éliminer les antidotes contenus dans le sang, les doses d'antidotes doivent être augmentées pour compenser[5]. Si l'hémodialyse n’est pas disponibles, alors la dialyse péritonéale permet également d’éliminer l'éthylène glycol, bien que d’une façon moins efficace[32].
Pronostic[modifier | modifier le code]
En général, si le patient est traité et survit, une guérison complète est attendue[33]. Les patients qui se présentent tôt aux urgences médicales et ont rapidement un traitement médical auront en général une issue favorable[34]. Inversement, les patients se présentant en retard et déjà dans le coma, présentant une hyperkaliémie, des convulsions, ou une acidose sévère ont un mauvais pronostic[4]. Les patients qui développent des manifestations sévères du système nerveux central ou un accident vasculaire cérébral et qui survivent, peuvent présenter un dysfonctionnement neurologique à long terme, dans certains cas ils peuvent récupérer, bien que la convalescence puisse se prolonger[35],[36],[37],[38]. Les complications les plus importantes à long terme sont liées à la fonction rénale. Des cas de lésion rénale irréversible, nécessitant le plus souvent une dialyse chronique ou une transplantation rénale, ont été signalés après de graves intoxications[39],[40].
Épidémiologie[modifier | modifier le code]
L’intoxication par l'éthylène glycol est relativement fréquente dans le monde entier[40],[41],[42],[43].Les cas humains d'intoxication surviennent souvent de façon isolée, mais peuvent également se produire sous forme d’épidémies[44],[45],[46]. De nombreux cas d'intoxication sont le résultat de l’utilisation d'éthylène glycol comme substitut bon marché de l'alcool ou d’ingestions intentionnelles au cours de tentatives de suicide[33]. Moins fréquemment, il a été utilisé dans un but d’homicide[47],[48]. Des enfants ou des animaux peuvent être exposés par ingestion accidentelle, les enfants et souvent les animaux en consomment de grandes quantités en raison de la saveur sucrée de l'éthylène glycol[49]. Aux États-Unis, il y eut 5 816 cas signalés aux centres antipoisons en 2002[4]. En outre, l'éthylène glycol est la cause la plus fréquente de décès liée à des produits chimiques signalés par les centres antipoisons des États-Unis en 2003[41]. En Australie, il y a eu 17 cas signalés par les centres antipoisons de l’État de Victoria et 30 cas signalés aux centres antipoisons de la Nouvelle-Galles du Sud en 2007[50],[51]. Toutefois, ces données peuvent sous-estimer les chiffres réels parce que tous les cas imputables à l'éthylène glycol ne sont pas signalés aux centres antipoisons[52]. La plupart des décès lies à l'éthylène glycol sont des suicides intentionnels, les décès d'enfants dus à l'ingestion involontaire sont extrêmement rares[53].
Dans un effort visant à prévenir l'intoxication, un agent amer appelé benzoate de denatonium, connu sous le nom commercial de Bitrex, est souvent ajouté à l'éthylène glycol pour éviter l’ingestion accidentelle ou intentionnelle. L’agent amer est censé mettre fin à l'ingestion en se fondant sur la fait que la principale défense de l'homme contre l'ingestion de substances nocives est le rejet des substances amères[54]. Aux États-Unis, trois États (Oregon, Californie, Nouveau-Mexique) ont rendu obligatoire l’ajout d’agents amers dans l'antigel[53],[55]. Les études évaluant l'efficacité des agents amers dans la prévention de l’intoxication ou de la mortalité ont cependant montré un effet limité de l’adjonction de préparations amères à l'éthylène glycol[53],[56].
Article connexe[modifier | modifier le code]
- Cachou, ours mort en 2020 dans les Pyrénées espagnoles par ingestion d'éthylène glycol, probablement empoisonné[57]
Références[modifier | modifier le code]
- Dr Eric Trénel, « Intoxication du chien et du chat à l’antigel (Ethylène Glycol) », sur veto.com, Conseils Véto / Optimvet, (consulté le ).
- (en) Hanzlik PJ, Seidenfeld MA, Johnson CC, « General properties, irritant and toxic actions of ethylene glycol », J. Pharmacol. Exp. Ther., vol. 41, , p. 387–406 (lire en ligne)
- (en) Friedman EA, Greenberg JB, Merrill JP, Dammin GJ, « Consequences of ethylene glycol poisoning. Report of four cases and review of the literature », Am. J. Med., vol. 32, , p. 891–902 (PMID 13895244, DOI 10.1016/0002-9343(62)90035-9)
- (en) Caravati EM, Erdman AR, Christianson G, et al, « Ethylene glycol exposure: an evidence-based consensus guideline for out-of-hospital management », Clin. Toxicol., vol. 43, no 5, , p. 327–45 (PMID 16235508, DOI 10.1080/07313820500184971)
- (en) Brent J, « Current management of ethylene glycol poisoning », Drugs, vol. 61, no 7, , p. 979–88 (PMID 11434452, DOI 10.2165/00003495-200161070-00006)
- (en) Eder AF, McGrath CM, Dowdy YG, Tomaszewski JE, Rosenberg FM, Wilson RB, Wolf BA, Shaw LM, « Ethylene glycol poisoning: toxicokinetic and analytical factors affecting laboratory diagnosis », Clinical chemistry, vol. 44, no 1, , p. 168–77 (PMID 9550575, lire en ligne)
- (en) Field DL, « Acute ethylene glycol poisoning », Critical care medicine, vol. 13, no 10, , p. 872–3 (PMID 4028762, DOI 10.1097/00003246-198510000-00024)
- (en) Amathieu R, Merouani M, Borron SW, Lapostolle F, Smail N, Adnet F, « Prehospital diagnosis of massive ethylene glycol poisoning and use of an early antidote », Resuscitation, vol. 70, no 2, , p. 285–6 (PMID 16808995, DOI 10.1016/j.resuscitation.2005.12.014)
- (en) Hodgman MJ, Wezorek C, Krenzelok E, « Toxic inhalation of ethylene glycol: a pharmacological improbability », Journal of toxicology. Clinical toxicology, vol. 35, no 1, , p. 109–11 (PMID 9022663)
- (en) Wills JH, Coulston F, Harris ES, McChesney EW, Russell JC, Serrone DM, « Inhalation of aerosolized ethylene glycol by man », Clin. Toxicol., vol. 7, no 5, , p. 463–76 (PMID 4613525)
- (en) Driver J, Tardiff RG, Sedik L, Wester RC, Maibach HI, « In vitro percutaneous absorption of [14C] ethylene glycol », Journal of exposure analysis and environmental epidemiology, vol. 3, no 3, , p. 277–84 (PMID 8260837)
- (en) Barceloux DG, Krenzelok EP, Olson K, Watson W., « American Academy of Clinical Toxicology Practice Guidelines on the Treatment of Ethylene Glycol Poisoning. Ad Hoc Committee », Journal of toxicology. Clinical toxicology, vol. 37, no 5, , p. 537–60 (PMID 10497633, DOI 10.1081/CLT-100102445)
- (en) Bobbitt WH, Williams RM, Freed CR, « Severe ethylene glycol intoxication with multisystem failure », Western journal of medicine, vol. 144, no 2, , p. 225–8 (PMID 3953092, PMCID 1306577)
- (en) Maier W, « Cerebral computed tomography of ethylene glycol intoxication », Neuroradiology, vol. 24, no 3, , p. 175–7 (PMID 6828232)
- (en) Gabow PA, Clay K, Sullivan JB, Lepoff R, « Organic acids in ethylene glycol intoxication », Annals of internal medicine, vol. 105, no 1, , p. 16–20 (PMID 3717806)
- (en) Clay KL, Murphy RC, « On the metabolic acidosis of ethylene glycol intoxication », Toxicology and applied pharmacology, vol. 39, no 1, , p. 39–49 (PMID 14421, DOI 10.1016/0041-008X(77)90175-2)
- (en) Hall TL, « Fomepizole in the treatment of ethylene glycol poisoning », CJEM : Canadian journal of emergency medical care = JCMU : journal canadien de soins médicaux d'urgence, vol. 4, no 3, , p. 199–204 (PMID 17609006, lire en ligne)
- (en) Aarstad K, Dale O, Aakervik O, Ovrebø S, Zahlsen K, « A rapid gas chromatographic method for determination of ethylene glycol in serum and urine », Journal of analytical toxicology, vol. 17, no 4, , p. 218–21 (PMID 8371550)
- (en) Jacobsen D, McMartin KE, « Antidotes for methanol and ethylene glycol poisoning », J. Toxicol. Clin. Toxicol., vol. 35, no 2, , p. 127–43 (PMID 9120880, DOI 10.3109/15563659709001182)
- (en) Hoffman RS, Smilkstein MJ, Howland MA, Goldfrank LR, « Osmol gaps revisited: normal values and limitations », Journal of toxicology. Clinical toxicology, vol. 31, no 1, , p. 81–93 (PMID 8433417)
- (en) Glaser DS, « Utility of the serum osmol gap in the diagnosis of methanol or ethylene glycol ingestion », Annals of emergency medicine, vol. 27, no 3, , p. 343–6 (PMID 8599495, DOI 10.1016/S0196-0644(96)70271-8)
- (en) Jacobsen D, Akesson I, Shefter E, « Urinary calcium oxalate monohydrate crystals in ethylene glycol poisoning », Scandinavian journal of clinical and laboratory investigation, vol. 42, no 3, , p. 231–4 (PMID 7134806)
- (en) Winter ML, Ellis MD, Snodgrass WR, « Urine fluorescence using a Wood's lamp to detect the antifreeze additive sodium fluorescein: a qualitative adjunctive test in suspected ethylene glycol ingestions », Annals of emergency medicine, vol. 19, no 6, , p. 663–7 (PMID 2344083, DOI 10.1016/S0196-0644(05)82472-2)
- (en) Wallace KL, Suchard JR, Curry SC, Reagan C, « Diagnostic use of physicians' detection of urine fluorescence in a simulated ingestion of sodium fluorescein-containing antifreeze », Annals of emergency medicine, vol. 38, no 1, , p. 49–54 (PMID 11423812, DOI 10.1067/mem.2001.115531)
- (en) Vale JA, Kulig K, « Position paper: gastric lavage », J. Toxicol. Clin. Toxicol., vol. 42, no 7, , p. 933–43 (PMID 15641639, DOI 10.1081/CLT-200045006)
- (en) Fountain JS, Beasley DM, « Activated charcoal supercedes ipecac as gastric decontaminant », The New Zealand Medical Journal, vol. 111, no 1076, , p. 402–4 (PMID 9830429)
- (en) Brent J, McMartin K, Phillips S, Burkhart K, Donovan J, Wells M, Kulig K, « Fomepizole for the treatment of ethylene glycol poisoning. Methylpyrazole for Toxic Alcohols Study Group », The New England Journal of Medicine, vol. 340, no 11, , p. 832–8 (PMID 10080845, DOI 10.1056/NEJM199903183401102)
- (en) Borron SW, Mégarbane B, Baud FJ, « Fomepizole in treatment of uncomplicated ethylene glycol poisoning », The Lancet, vol. 354, no 9181, , p. 831 (PMID 10485727, DOI 10.1016/S0140-6736(99)80015-4)
- (en) Shannon M, « Toxicology reviews: fomepizole--a new antidote », Pediatric emergency care, vol. 14, no 2, , p. 170–2 (PMID 9583406)
- (en) Scalley RD, Ferguson DR, Piccaro JC, Smart ML, Archie TE, « Treatment of ethylene glycol poisoning », American family physician, vol. 66, no 5, , p. 807–12 (PMID 12322772)
- (en) Moreau CL, Kerns W, Tomaszewski CA, McMartin KE, Rose SR, Ford MD, Brent J, « Glycolate kinetics and hemodialysis clearance in ethylene glycol poisoning. META Study Group », J. Toxicol. Clin. Toxicol., vol. 36, no 7, , p. 659–66 (PMID 9865233)
- Aakervik O, Svendsen J, Jacobsen D, « [Severe ethylene glycol poisoning treated with fomepizole (4-methylpyrazole)] », Tidsskrift for den Norske lægeforening : tidsskrift for praktisk medicin, ny række, vol. 122, no 25, , p. 2444–6 (PMID 12448112)
- (en) Leth PM, Gregersen M, « Ethylene glycol poisoning », Forensic science international, vol. 155, nos 2-3, , p. 179–84 (PMID 16226155, DOI 10.1016/j.forsciint.2004.11.012)
- (en) Velez LI, Shepherd G, Lee YC, Keyes DC, « Ethylene glycol ingestion treated only with fomepizole », Journal of medical toxicology : official journal of the American College of Medical Toxicology, vol. 3, no 3, , p. 125–8 (PMID 18072148, lire en ligne [PDF])
- (en) Jacobsen D, McMartin KE, « Methanol and ethylene glycol poisonings. Mechanism of toxicity, clinical course, diagnosis and treatment », Medical toxicology, vol. 1, no 5, , p. 309–34 (PMID 3537623)
- (en) Berger JR, Ayyar DR, « Neurological complications of ethylene glycol intoxication. Report of a case », Archives of neurology, vol. 38, no 11, , p. 724–6 (PMID 7305705)
- (en) Lewis LD, Smith BW, Mamourian AC, « Delayed sequelae after acute overdoses or poisonings: cranial neuropathy related to ethylene glycol ingestion », Clinical pharmacology and therapeutics, vol. 61, no 6, , p. 692–9 (PMID 9209253, DOI 10.1016/S0009-9236(97)90105-3)
- (en) Spillane L, Roberts JR, Meyer AE, « Multiple cranial nerve deficits after ethylene glycol poisoning », Annals of emergency medicine, vol. 20, no 2, , p. 208–10 (PMID 1996809, DOI 10.1016/S0196-0644(05)81226-0)
- Nizze H, Schwabbauer P, Brachwitz C, Lange H, « [Fatal chronic oxalosis after sublethal ethylene glycol poisoning] », Pathologe, vol. 18, no 4, , p. 328–34 (PMID 9380607, DOI 10.1007/s002920050224, lire en ligne)
- (en) Davis DP, Bramwell KJ, Hamilton RS, Williams SR, « Ethylene glycol poisoning: case report of a record-high level and a review », The Journal of emergency medicine, vol. 15, no 5, , p. 653–67 (PMID 9348055, DOI 10.1016/S0736-4679(97)00145-5)
- (en) Watson WA, Litovitz TL, Klein-Schwartz W, Rodgers GC Jr, Youniss J, Reid N, Rouse WG, Rembert RS, Borys D, « 2003 annual report of the American Association of Poison Control Centers Toxic Exposure Surveillance System », The American journal of emergency medicine, vol. 22, no 5, , p. 335–404 (PMID 15490384, DOI 10.1016/j.ajem.2004.06.001)
- (en) Kotwica M, Czerczak S, « Acute poisonings registered since 1970: trends and characteristics. Analysis of the files collected in the National Poison Information Centre, Łódź, Poland », International journal of occupational medicine and environmental health, vol. 20, no 1, , p. 38–43 (PMID 17509968, DOI 10.2478/v10001-007-0010-8)
- (en) « Ethylene glycol intoxication due to contamination of water systems », MMWR. Morbidity and mortality weekly report, vol. 36, no 36, , p. 611–4 (PMID 3114608)
- (en) Leikin JB, Toerne T, Burda A, McAllister K, Erickson T, « Summertime cluster of intentional ethylene glycol ingestions », JAMA : the journal of the American Medical Association, vol. 278, no 17, , p. 1406 (PMID 9355997, DOI 10.1001/jama.278.17.1406)
- (en) Goldsher M, Better OS, « Antifreeze poisoning during the October 1973 War in the Middle-East: case reports », Military medicine, vol. 144, no 5, , p. 314–5 (PMID 113700)
- (en) Armstrong EJ, Engelhart DA, Jenkins AJ, Balraj EK, « Homicidal ethylene glycol intoxication: a report of a case », The American journal of forensic medicine and pathology : official publication of the National Association of Medical Examiners, vol. 27, no 2, , p. 151–5 (PMID 16738434, DOI 10.1097/01.paf.0000203221.17854.38)
- Munro Ian, « Death by anti-freeze 'perfect murder' », The Age, (consulté le )
- (en) [edited by] Lewis R. Goldfrank ... [et al.] ; with 116 contributors., Goldfrank’s toxicologic emergencies, McGraw-Hill, , 980–90 p. (ISBN 0-07-136001-8, OCLC 48177200)
- « Annual Report 2007 » [PDF], Victorian Poisons Information Centre, (consulté le )
- « Annual Report 2007 » [PDF], New South Wales Poisons Information Centre, (consulté le )
- (en) LaKind JS, McKenna EA, Hubner RP, Tardiff RG, « A review of the comparative mammalian toxicity of ethylene glycol and propylene glycol », Critical Reviews in Toxicology, vol. 29, no 4, , p. 331–65 (PMID 10451263, DOI 10.1080/10408449991349230)
- (en) White NC, Litovitz T, White MK, Watson WA, Benson BE, Horowitz BZ, Marr-Lyon L, « The impact of bittering agents on suicidal ingestions of antifreeze », Clin. Toxicol., vol. 46, no 6, , p. 507–14 (PMID 18584362, DOI 10.1080/15563650802119700)
- (en) Jackson MH, Payne HA, « Bittering agents: their potential application in reducing ingestions of engine coolants and windshield wash », Veterinary and human toxicology, vol. 37, no 4, , p. 323–6 (PMID 8540219)
- (en) Neumann CM, Giffin S, Hall R, Henderson M, Buhler DR, « Oregon's Toxic Household Products Law », Journal of public health policy, vol. 21, no 3, , p. 342–59 (PMID 11021047, DOI 10.2307/3343331)
- (en) Mullins ME, Zane Horowitz B, « Was it necessary to add Bitrex (denatonium benzoate) to automotive products? », Veterinary and human toxicology, vol. 46, no 3, , p. 150–2 (PMID 15171494)
- Stéphanie Bascou, « Un ancien élu et un garde forestier espagnols inculpés pour l’empoisonnement de l'ours Cachou », sur geo.fr.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ethylene glycol poisoning » (voir la liste des auteurs).
