Dendralène
Les dendralènes sont des polyènes acycliques à conjugaison croisée. Le plus simple des dendralènes est le butadiène (1) ou [2]dendralène suivi du [3]dendralène (2), du [4]dendralène (3) et du [5]dendralène (4) et ainsi de suite.

Le nom dendralène est un mot-valise issu des mots dendrimère, linéaire et alcène. Les plus hauts dendralènes sont d'un grand intérêt scientifique car ils ouvrent un large éventail de nouveaux composés organiques accessibles via des précurseurs simples, spécialement avec la réaction de Diels-Alder. Leurs contreparties cycliques sont pertinemment appelés radialènes.
Synthèse[modifier | modifier le code]
Le vinylbutadiène ([3]dendralène) a été préparé en 1955 par pyrolyse d'un triacétate[1],[2] :
Un chemin de synthèse du [4]dendralène part du chloroprène[3]. Ce composé est converti en un réactif de Grignard par l'action de magnésium métallique et réagit avec du chlorure de cuivre(I) pour former un intermédiaire organocuivreux (en) qui dimérise dans une réaction de couplage avec le chlorure de cuivre(II) pour former le dimère de butadiène.
![synthèse du [4]dendralène à partir du chloroprène](http://upload.wikimedia.org/wikipedia/commons/8/86/-4-dendralenesynthesis.png)
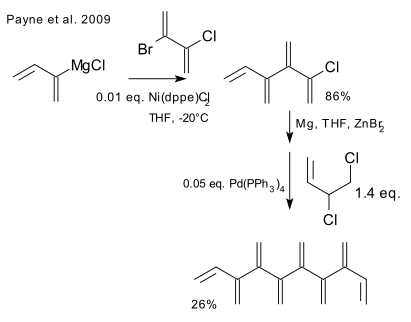
La synthèse du [8]dendralène a été publiée en 2009[4]:
Notes[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dendralene » (voir la liste des auteurs).
- William J. Bailey, James Economy, Pyrolysis of Esters. III. Synthesis of 2-Vinylbutadiene, J. Am. Chem. Soc., 1955, vol. 77(5), pp. 1133-1136. DOI 10.1021/ja01610a014.
- A. T. Blomquist, Joseph A. Verdol, 2-Vinyl-1,3-butadiene, J. Am. Chem. Soc., 1955, vol. 77(1), pp. 81–83. DOI 10.1021/ja01606a025.
- Alan D. Payne, Anthony C. Willis, and Michael S. Sherburn (2005). "Practical Synthesis and Diels-Alder Chemistry of [4]Dendralene". Journal of the American Chemical Society, 127 (35): 12188–12189.
- Alan D. Payne, Gomotsang Bojase, Michael N. Paddon-Row, and Michael S. Sherburn, Practical Synthesis of the Dendralene Family Reveals Alternation in Behavior, Angew. Chem. Int. Ed., 2009, vol. 48(26), pp. 4836–4839. DOI 10.1002/anie.200901733/