Cétone de Michler
| Cétone de Michler | |
| |
| Identification | |
|---|---|
| Nom UICPA | 4,4'-bis(diméthylamino)benzophénone |
| No CAS | |
| No ECHA | 100.001.843 |
| No RTECS | DJ0250000 |
| PubChem | 7031 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores[1] |
| Propriétés chimiques | |
| Formule | C17H20N2O |
| Masse molaire[2] | 268,353 5 ± 0,015 7 g/mol C 76,09 %, H 7,51 %, N 10,44 %, O 5,96 %, |
| Propriétés physiques | |
| T° fusion | 172 à 175 °C[1] |
| Solubilité | 0,4 g·l-1 (eau, 20 °C)[1] |
| T° d'auto-inflammation | 480 °C[1] |
| Point d’éclair | 220 °C[1] |
| Précautions | |
| SGH[1] | |
| H318, H341, H350, P201, P280, P305+P351+P338 et P308+P313 |
|
| NFPA 704[3] | |
| Écotoxicologie | |
| LogP | 3,87[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
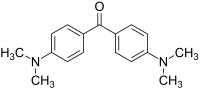
La cétone de Michler (4,4'-bis(diméthylamino)benzophénone), est un composé organique de formule [(CH3)2NC6H4]2CO. Ce dérivé de la benzophénone riche en électrons est un intermédiaire dans la production de teintures et de pigments comme le violet de méthyle ou le vert malachite, ainsi que comme photosensibilisateur (en)[4]. Elle tient son nom du chimiste allemand Wilhelm Michler qui l'a découverte et synthétisée en 1875[5].
Synthèse[modifier | modifier le code]
La cétone est toujours préparée de nos jours de la même façon que la synthèse originelle de Michler, à savoir une acylation de Friedel-Crafts de la diméthylaniline (C6H5NMe2) par le phosgène (COCl2) ou un réactif équivalent (triphosgène par exemple)[5] :
- COCl2 + 2 C6H5NMe2 → (Me2NC6H4)2CO + 2 HCl
Le dérivé tétraethylé (Et2NC6H4)2CO, aussi précurseur de certains pigments, est produit de la même façon.
Utilisations[modifier | modifier le code]
La cétone de Michler est un intermédiaire dans la synthèse de teintures et pigments utilisé sur du papier, des textiles ou du cuir. Sa condensation avec divers dérivés de l'aniline produit plusieurs composés de la famille des violets de méthyle, notamment le violet de gentiane.
La condensation avec la N-phényl-1-naphthylamine donne le Victoria Blue B (CI Basic Blue 26), utilisé pour colorer certains papiers, et dans la production de pâte et encre pour les stylos à bille.
La cétone de Michler est communément utilisée comme additif dans certaines teintures et pigments comme sensibilisant pour des photoréactions du fait de ses propriétés d'absorption. C'est un sensibilisant efficace à condition que le transfert d'énergie soit exothermique et que la concentration en accepteur soit suffisamment élevée pour empêcher la photoréaction de la cétone de Michler avec elle-même. En particulier, la cétone de Michler absorbe particulièrement un radiation à 366 nm sensibilise efficacement less réaction photochimiques telles que la dimérisation du butadiène donnant le 1,2-divinylcyclobutane[6].
Composés proches[modifier | modifier le code]
La p-diméthylaminobenzophénone est similaire à la cétone de Michler, mais avec un seul groupe amine[7]. La base de Michler possède la même structure que la cétone, la fonction cétone en moins. L'auramine O, un colorant jaune doré, a une structure similaire mais avec un groupe imine à la place du carbonyle (plus précisément, c'est le sel de chlore du cation iminium, [(CH3)2NC6H4]2CNH2+). La thione de Michler, [(CH3)2NC6H4]2CS, est produite par le traitement de la cétone de Michler par le sulfure d'hydrogène en milieu acide, ou par sulfuration de l'auramine O[8].
Notes et références[modifier | modifier le code]
- Entrée « 4,4'-Bis(dimethylamino)-benzophenone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 septembre 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Michler’s ketone, consultée le 23 septembre 2019.
- Kan, Robert O., Organic Photochemistry, New York, McGraw-Hill,
- W. Michler, « Synthese aromatischer Ketone mittelst Chlorkohlenoxyd », Berichte der Deutschen Chemischen Gesellschaft, vol. 9, , p. 716–718 (DOI 10.1002/cber.187600901218, lire en ligne)
- Charles D. DeBoer, Nicholas J. Turro, and George S. Hammond, cis- and trans-1,2-Divinylcyclobutane, Org. Synth., coll. « vol. 5 », , p. 528
- Charles D. Hurd et Carl N. Webb, « p-Dimethylaminobenzophenone », Organic Syntheses, vol. 7, , p. 24 (DOI 10.15227/orgsyn.007.0024)
- R. M. Elofson, Leslie A. Baker, F. F. Gadallah et R. A. Sikstrom, « The Preparation of Thiones in the Presence of Anhydrous Hydrogen Fluoride », The Journal of Organic Chemistry, vol. 29, no 6, , p. 1355 (DOI 10.1021/jo01029a020)



