Acide cyanurique
| Acide cyanurique | |
| |
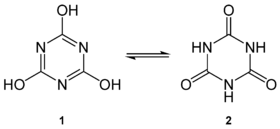
| Tautomères : 1- acide cyanurique et 2-acide isocyanurique. | |
| Identification | |
|---|---|
| Nom UICPA | 1,3,5-triazine-2,4,6-triol |
| Synonymes |
Acide isocyanurique |
| No CAS | |
| No ECHA | 100.003.290 |
| No CE | 203-618-0 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline blanche, hygroscopique, inodore[1]. |
| Propriétés chimiques | |
| Formule | C3H3N3O3 [Isomères] |
| Masse molaire[2] | 129,074 2 ± 0,004 1 g/mol C 27,92 %, H 2,34 %, N 32,56 %, O 37,19 %, |
| Propriétés physiques | |
| T° fusion | Se décompose au-dessous du point de fusion à 320–360 °C[1] |
| Solubilité | dans l'eau à 25 °C : 2 g·l-1[1] |
| Masse volumique | 2,5 g·cm-3 |
| Précautions | |
| SIMDUT[3] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide cyanurique ou acide isocyanurique ou s-triazine-2,4,6-triol est un hétérocycle aromatique de formule semi-développée C3N3(OH)3. Sa structure moléculaire consiste en un hétérocycle à 6 où alternent trois atomes de carbone avec trois atomes d'azote. Chaque atome de carbone est lié à l'oxygène d'un groupe hydroxyle (-OH). Il possède une forme tautomère qui est la s-triazine-2,4,6-trione, aussi nommé acide isocyanurique. Il peut produire des sels et des esters sous forme de cyanurates et d'isocyanurates.
Environnement[modifier | modifier le code]
Il s'accumule dans l'eau traitée au chlore quand ce dernier est stabilisé aux UV par de l'isocyanure.
C'est un produit bioaccumulable (par exemple chez les bivalves)[4].
Sa structure chimique particulière ne laisse pas de point d'accès aisé pour l'oxydation, tant biocatalytique que chimique, ce qui rend ce composé particulièrement résistant aux traitements de dépollution de l'eau.
Toxicité[modifier | modifier le code]
Ce peut être un produit de dégradation d'autres produits chimiques, et il peut agir en synergie avec d'autres produits (toxicité soupçonnée pour le rein chez l'animal en présence de mélamine par exemple).
Applications[modifier | modifier le code]
L'acide cyanurique est utilisé comme chlore stabilisant / tampon dans les piscines. Il se lie au chlore libre et le libère lentement, prolongeant ainsi le temps nécessaire pour épuiser chaque dose de désinfectant.
La teroxirone, un médicament antinéoplasique, est formée en faisant réagir l'acide cyanurique avec trois équivalents d’épichlorhydrine[5].
Sources et références[modifier | modifier le code]
- Merck KGaA Chem Dat
- ACIDE CYANURIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Acide cyanurique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Fiche CNRS INIST
- M. Budnowski, Angew. Chem., 7, 827 (1968).

