Aziridine
| Aziridine | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | aziridine |
| Synonymes |
azacyclopropane |
| No CAS | |
| No ECHA | 100.005.268 |
| No CE | 205-793-9 |
| PubChem | 9033 |
| ChEBI | 30969 |
| SMILES | |
| InChI | |
| Apparence | liquide huileux incolore et clair[1] |
| Propriétés chimiques | |
| Formule | C2H5N [Isomères] |
| Masse molaire[3] | 43,067 8 ± 0,002 2 g/mol C 55,78 %, H 11,7 %, N 32,52 %, |
| Moment dipolaire | 1,90 ± 0,01 D [2] |
| Propriétés physiques | |
| T° fusion | −78 °C [4] |
| T° ébullition | 56 °C [4] |
| Masse volumique | 0,832 1 g·cm-3 à 20 °C[5] |
| T° d'auto-inflammation | 320 °C [6] |
| Point d’éclair | −13 °C [6] |
| Limites d’explosivité dans l’air | 3,6–46 %vol 64–820 g·cm-3 [6] |
| Pression de vapeur saturante | 213 mbar à 20 °C 333 mbar à 30 °C 780 mbar à 50 °C [6] |
| Thermochimie | |
| ΔfH0liquide | 91,9 kJ·mol-1 [4] |
| Cp | |
| PCI | −1 591,36 kJ·mol-1 [4] |
| Précautions | |
| SIMDUT[9] | |
   B2, D1A, D2A, E, |
|
| NFPA 704[10] | |
| Directive 67/548/EEC | |
| Transport[6] | |
| Classification du CIRC | |
| Groupe 2B : Peut-être cancérogène pour l'homme[8] | |
| Écotoxicologie | |
| DL50 | 15 mg·kg-1 (rat, oral) 3,5 mg·kg-1 (rat, i.p.) 4 mg·kg-1 (souris, i.p.) [11] |
| Seuil de l’odorat | bas : 2 ppm[12] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'aziridine (n.f.) ou azacyclopropane est le composé organique cyclique de formule brute C2H5N. Elle est aussi le composé parent des aziridines et du groupe fonctionnel qui correspond à un hétérocycle à trois côtés composé d'une amine et de deux groupes méthylène[13],[14].
Production et synthèse[modifier | modifier le code]
Les aziridines peuvent être préparées en chimie organique de nombreuses façons.
Cyclisation d'haloamines et d'amino-alcools[modifier | modifier le code]
Un groupe amine peut déplacer un halogénure adjacent (en β) dans une réaction de substitution nucléophile intramoléculaire pour former une aziridine. Les amino-alcools ont la même réactivité mais il faut tout d'abord convertir les groupes hydroxyde en meilleurs groupes partants, par exemple en tosylate. La cyclisation d'un amino-alcool est appelé synthèse de Wenker (en) (1935) et une d'haloamine, la éthylènimine-méthode de Gabriel (1888)[15]
Addition de nitrène[modifier | modifier le code]
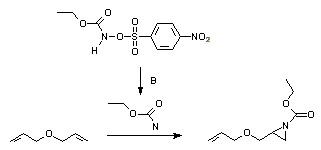
L'addition d'un nitrène sur un alcène est une méthode bien établie pour la synthèse des aziridines. Photolyses ou thermolyses d'azotures sont une bonne voie pour générer des nitrènes. Ceux-ci peuvent aussi être générés in-situ du diacétate d'iodobenzène et des sulfamidés ou sulfamates, ou de l'éthoxycarbonylnitrène d'un N-sulfonyloxy précurseur[16]:
Décomposition de triazolines[modifier | modifier le code]
Sous traitement thermique ou par photolyse d'une triazoline, de l'azote est expulsé et reste une aziridine[17]. La triazoline requise est obtenue d'une réaction de cycloaddition d'un azoture sur un alcène.

Via l'ouverture d'un époxyde[modifier | modifier le code]
Une méthode consiste en une réaction d'ouverture de cycle d'un époxyde avec l'azoture de sodium suivie d'une réduction organique de l'azoture obtenu avec la triphénylphosphine par expulsion d'azote gazeux[18]:
Une autre méthode consiste en la réaction d'ouverture d'un époxyde par une amine suivie de la refermeture du cycle par une réaction de Mitsunobu[19].
Réaction d'un oxime avec un réactif de Grignard[modifier | modifier le code]
L'éthylènimine synthèse de Hoch-Campbell décrit la synthèse d'aziridines par la réaction de certains oximes avec des réactifs de Grignard[20],[21]:
Caractéristiques physico-chimiques[modifier | modifier le code]
Structure[modifier | modifier le code]
Les angles des liaisons dans l'aziridine sont autour de 60 ° ce qui considérablement moins que l'angle de 109,5 ° normalement trouvé dans les hydrocarbures ou les amines linéaires et non contraints. Ces angles sont cependant comparables à ceux trouvés dans les cycles cyclopropane ou oxirane et correspondent aux mêmes contraintes angulaires dans le cycle : les liaisons dans ce type de cycle peuvent être expliquées en invoquant un modèle de liaison banane. L'aziridine est moins basique qu'une amine acyclique et aliphatique avec un pKa de 7.9 pour l'acide conjugué ce qui est dû à un accroissement du caractère s dans la paire libre de l'azote. Les contraintes angulaires accrues dans l'aziridine sont aussi responsables de l'accroissement de la barrière d'énergie pour l'inversion de l'azote. Cette barrière est suffisamment haute dans les aziridines pour pouvoir séparer des invertomères comme les invertomères cis et trans de la N-chloro-2-méthylaziridine.
Réactions[modifier | modifier le code]
Ouverture de cycle nucléophilique[modifier | modifier le code]
Les aziridines sont des substrats sensibles aux réactions d'ouverture de cycle avec beaucoup de nucléophiles à cause des contraintes moléculaires dans le cycle. Alcoolyses et ammonialyses sont typiquement les réactions inverses des cyclisations. D'autres nucléophiles efficaces sont les carbones nucléophiles comme dans les réactifs organolithiens ou les organocuprates comme le réactif de Gilman.
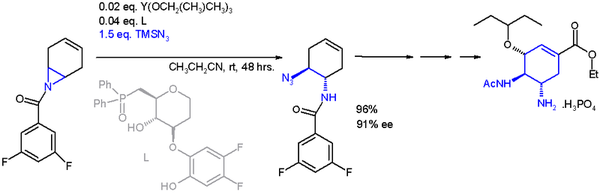
Une application importante d'une réaction d'ouverture de cycle en synthèse asymétrique est celle avec le triméthylsilylazoture TMSN3 et un ligand asymétrique[22]:
Le catalyseur est construit sur l'yttrium et trois substituants isopropyloxy, le ligand est une phosphine oxyde. Avec un excès énantiomérique de 91 % ee, cette réaction permet une synthèse totale de l'oseltamivir (Tamiflu).
Autres réactions[modifier | modifier le code]
Les aziridines non N-substituées peuvent être ouvertes par des alcènes en présence d'un acide de Lewis fort comme B(C6F5)3[23] Certaines aziridines N-substituées et avec des groupes attracteurs d'électron sur les deux atomes de carbone forment des azométhine ylures par une réaction électrocyclique (en) d'ouverture de cycle. Ces ylures peuvent être piégés avec un dipolarophile idoine par une cycloaddition 1,3-dipolaire.
Sécurité[modifier | modifier le code]
La toxicologie de chaque aziridine spécifique dépend de sa propre structure et activité qui participe des caractéristiques générales du groupe des aziridines. Étant électrophile, les aziridines sont susceptibles d'attaquer et de voir leur cycle ouvert par des nucléophiles endogènes tels que les bases nucléiques de l'ADN ce qui correspond à un potentiel mutagène[24],[25],[26], et peut également induire dans certains cas une activité antitumorale[27].
Ainsi inhalation et contact direct avec les aziridines sont proscrits. Certains rapports notent que même des gants utilisés normalement en chimie ne préviennent pas l'infiltration cutanée des aziridines. Il est donc important que les utilisateurs vérifient les temps d'imprégnation des gants et fassent scrupuleusement attention au fait d'éviter la contamination lors du retrait des gants.
Le Centre international de recherche sur le cancer (CIRC) a passé en revue les composés aziridines et les a classés comme carcinogène humain possible (Group 2B)[28]. En procédant à une évaluation globale, le groupe de travail du CIRC a pris en considération le fait que les aziridines sont des agents alkylants directs qui sont mutagènes dans une large gamme de systèmes d'essai et forment des adduits d'ADN qui sont promutagènes.
Les aziridines provoquent des effets irritants sur les muqueuses telles les yeux, le nez, le système respiratoire et même la peau. Les aziridines pénètrent rapidement à travers la peau en cas de contact. Elles peuvent causer des dermatoses allergiques et de l'urticaire ou donner un asthme occupationnel.
Notes[modifier | modifier le code]
- Aziridine.pdf sur IARC
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Ethylenimine », sur NIST/WebBook, consulté le 22 juillet 2009
- CRC Handbook of Chemistry and Physics, 59th ed, (ISBN 978-0-8493-0549-8)
- Entrée « Ethyleneimine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 juillet 2009 (JavaScript nécessaire)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur monographs.iarc.fr, CIRC, (consulté le ).
- « Éthylène imine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 22 juillet 2009
- UCB Université du Colorado
- (en) « Aziridine », sur ChemIDplus, consulté le 22 juillet 2009
- « Ethyleneimine », sur hazmap.nlm.nih.gov (consulté le ).
- Heterocyclic chemistry, T.L. Gilchrist. (ISBN 0-582-01421-2)
- Epoxides and aziridines - A mini review, Albert Padwaa and S. Shaun Murphreeb; Arkivoc (JC-1522R), p. 6-33. article en ligne
- Gabriel Ethylenimine Method
- Addition reactions of ethoxycarbonylnitrene and ethoxycarbonylnitrenium ion to allylic ethers M. Antonietta Loreto et al.; Tetrahedron Letters, 1984, vol. 25(38),p. 4271-4274. Résumé
- Triazoline photodecomposition : The preparation of aziridines, P. Scheiner; Tetrahedron, 1968, vol. 24(6), p. 2757-2765. DOI 10.1016/S0040-4020(01)82547-3.
- Readily Available Unprotected Amino Aldehydes, Ryan Hili and Andrei K. Yudin; J. Am. Chem. Soc., 2006, vol. 128(46), p. 14772-14773. DOI 10.1021/ja065898s.
- Aravinda B. Pulipaka, Stephen C. Bergmeier.; Synthesis, 2008, vol. 9, p. 1420-1430
- Hoch, Compt. rend., 196, 1865 (1934); (a), ibid., aOS, 799 (1936); (e), ibid., 204, 358 (1937).
- The action of Grignard reagents on oximes. I. The action of phenylmagnesium bromide on mixed ketoximes, Kenneth N. Campbell, James F. Mckenna; J. Org. Chem., 1939, vol. 4(2), p. 198-205. DOI 10.1021/jo01214a012.
The reaction of Grignard reagents with oximes. II. The action of aryl grignard reagents with mixed ketoximes, Kenneth N. Campbell, Barbara Knapp Campbell, Elmer Paul Chaput; J. Org. Chem., 1943, vol. 8(1), p. 99-102. DOI 10.1021/jo01189a015.
The action of Grignard reagents on oximes. III. The mechanism of the action of arylmagnesium halides on mixed ketoximes. A new synthesis of ethyleneimines, Kenneth N. Campbell, Barbara K. Campbell, James F. Mckenna, and Elmer Paul Chaput; J. Org. Chem., 1943, p. 103-109. DOI 10.1021/jo01189a016 - De Novo Synthesis of Tamiflu via a Catalytic Asymmetric Ring-Opening of meso-Aziridines with TMSN3, Yuhei Fukuta et al.; J. Am. Chem. Soc., 2006, vol. 128(19), p. 6312-6313. DOI 10.1021/ja061696k.
- Aravinda B. Pulipaka and Stephen C. Bergmeier.; J. Org. Chem., 2008, vol. 73, p. 1462-1467
- Occupational respiratory and skin sensitization caused by polyfunctional aziridine hardener, L. Kanerva et al.; Clinical & Experimental Allergy, 1995, vol. 25(5), p. 432–439.
- Skin and respiratory allergic disease caused by polyfunctional aziridine, Sartorelli P et al.; Med Lav., 2003, vol.94(3), p. 285-95.
- Agents, old and new, causing occupational asthma, Mapp CE; Occup. Environ. Med., 2001, vol. 58, p. 354-60
- Giorgi-Renault, S., Renault J., Baron M., Gebel-Servolles, P., Delic, J., Cros S., Paoletti C., Heterocyclic quinones XIII. Dimerization in the series of 5,8-quinazolinediones: Synthesis and anti tumor effects of bis(4-amino-5,8-quinazolinediones), Chem. Pharm. Bull., 36 (10), 3933-3947 (1988).
- Volume 9.pdf, Some Aziridines,...
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Aziridine » (voir la liste des auteurs).
Lien externe[modifier | modifier le code]
- Désymétrisation d'aziridines méso en particulier à partir de 1.2.