RNase PH
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
La ribonucléase PH, également appelées RNase PH, exonucléase phosphate-dépendante et officiellement ARNt nucléotidyltransférase, est une 3'-5' exoribonucléase nucléotidyltransférase présente chez les archées et les bactéries et qui intervient dans la dégradation des ARN de transfert.
À la différence des enzymes hydrolytiques qui ont besoin d'une molécule d'eau comme cofacteur pour lar réaction, elle utilise un phosphate inorganique (phosphorylase) pour séparer dans la chaine de nucléotides, le nucléotide de l'extrémité 3'.
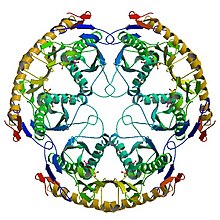
La forme active de l'enzyme est une structure protéique organisée en complexe homohexamérique, composée de trois dimères de RNase PH.
La RNase PH a des homologues dans de nombreux autres organismes qui sont désignés comme RNase PH-likes. Quand une partie d'une protéine a un grand domaine très similaire à la RNase PH, on l'appelle un domaine RNase PH (RNase PH domain (RPD)).
Notes et références[modifier | modifier le code]
- (en) Ryohei Ishii, Osamu Nureki et Shigeyuki Yokoyama, « Crystal Structure of the tRNA Processing Enzyme RNase PH from Aquifex aeolicus », Journal of Biological Chemistry, vol. 278, no 34, , p. 32397-32404 (PMID 12746447, DOI 10.1074/jbc.M300639200, lire en ligne)
Voir aussi[modifier | modifier le code]
Deux complexes très fortement liés aux exoribonucléases: