- Болезнь Хантингтона
-
Болезнь Хантингтона МКБ-10 G10., F02.2 МКБ-9 333.4, 294.1 OMIM 143100 DiseasesDB 6060 MedlinePlus 000770 Болезнь Хантингтона (синдром Хантингтона, хорея Хантингтона или Гентингтона) — генетическое заболевание нервной системы, характеризующееся постепенным началом обычно в возрасте 30-50 лет и сочетанием прогрессирующего хореического гиперкинеза и психических расстройств. Заболевание вызывается умножением кодона CAG в гене IT-15. Этот ген кодирует 350-kDa белок хантингтин с неизвестной функцией. В гене дикого типа (не мутантного) у разных людей присутствует разное количество CAG повторов, однако, когда число повторов превышает 36, развивается болезнь. Нейроморфологическая картина характеризуется атрофией стриатумa, а на поздней стадии также атрофией коры головного мозга.
Содержание
Эпидемиология
В настоящее время от хореи Хантингтона в США страдает около 7000 человек. Частота встречаемости заболевания среди населения с европейскими корнями составляет примерно 3-7:100000, и 1:1000000 среди остальных рас[1]. Название болезни дано в честь трёх поколений врачей, изучавших её в штате Коннектикут. В частности, считается, что заболевание названо в честь американского врача Джорджа Хантингтона, первым давшего его классическое описание[2][3].
Генетика
Ген хантингтин (HTT), присутствующий у всех людей, кодирует белок хантингтин (Htt). Ген HTT расположен на коротком плече 4-й хромосомы (4p16.3)[4]. Этот ген состоит из последовательности трёх азотистых оснований — цитозин-аденин-гуанин, которые повторяются множество раз (т.е. ... ЦАГЦАГЦАГ ...) и известны как тринуклеотидные повторы. Триплет ЦАГ кодирует аминокислоту глутамин, поэтому синтезируемый белок хантингтин состоит из цепочки глутаминовых аминокислот, называемых полиглутаминовый тракт[5].
Количество ЦАГ триплетов различно у отдельных лиц и может изменяться с последующими поколениями. Если их становится больше 36, то синтезируется удлинённый полиглутаминовый тракт и происходит образование мутантного белка хантингтина (mHtt)[6], который оказывает токсичное действие на клетки и вызывает болезнь Хантингтона. Как правило, от числа ЦАГ повторов зависит степень повреждений, наличие около 60% повторов сверх нормы вызывает появление симптомов в различном возрасте[4]. 36-40 повторов приводят к редуцированной пенетрантности формы этого заболевания, которая намного позже проявляется и медленнее прогрессирует. В некоторых случаях начало болезни может быть настолько поздним, что симптомы никогда не обнаруживаются[7]. При очень большом количестве повторов, болезнь Хантингтона имеет полную пенетрантность и может проявиться до 20 лет, тогда болезнь классифицируется как ювенильная, акинетически-ригидная или Вестфаль варианты. Составляет приблизительно 7% случаев болезни Хантингтона[8].
Мутантный ген был предположительно завезён в США в 1630 году двумя братьями, эмигрировавшими из Эссекса в Бостон[9][10].
Патогенез
Htt белок взаимодействует с сотней других белков и, вероятно, выполняет множество биологических функций[11]. Механизм действия mHtt до конца не ясен, но известно, что он токсичен для некоторых типов клеток, особенно в головном мозге. В основном происходит поражение полосатого тела (стриатума), но при прогрессировании заболевания и другие области головного мозга значительно повреждаются[6]. Планирование и коррекция движений — основная функция полосатого тела, и нарушения в этой области провоцируют симптомы[6].
Функция Htt
Htt образуется во всех клетках млекопитающих. Наибольшая его концентрация — в головном мозге и яичках, а также в умеренных количествах в печени, сердце и лёгких[6]. Функция Htt у человека не ясна. Он взаимодействует с белками, участвующими в транскрипции, передаче сигнала в клетке и внутриклеточном транспорте[6][12]. Некоторые функции Htt обнаружены в экспериментальных моделях животных: играет важную роль в развитии эмбриона и связан с гибелью эмбриона при отсутствии белка[13]. Он также выступает в качестве анти-апоптозного агента, предотвращая запрограммированную гибель клеток, и контролирует образование нейротрофического фактора мозга (белок, защищающий нейроны и регулирующий их образование во время нейрогенеза). Если экспрессия Htt возрастает, выживаемость нервных клеток увеличивается и эффект mHtt уменьшается, наоборот, понижение экспрессии Htt даёт картину более типичную присутствию mHtt[13]. У людей разрушение нормального гена не приводит к болезни. В настоящее время считается, что болезнь вызывает не недостаточное образование Htt, а усиление токсического эффекта mHtt[6].
Клеточные изменения под действием mHtt
Под действием образовавшегося mHtt происходит множество изменений в клетке, что вызывает болезнь Хантингтона. Удлинение полиглутаминовой последовательности изменяет конформацию белка хантингтина и прочно соединяет его с другими белками[14]. Это приводит к агрегации хантингтина, при этом образуются так называемые внутриклеточные тельца включения[15]. Эти включения механически препятствуют движению везикул, содержащих нейромедиаторы, через цитоскелет, что нарушает передачу сигналов в нейронах[15]. Тельца включения обнаруживают как в ядрах клеток, так и в цитоплазме. Некоторые эксперименты показали, что они могут быть токсичны для клеток, а другие — что тельца, наоборот, защищают нейрон от смерти, аккумулируя мутантный хантингтин, и именно неагрегированный белок токсичен[16].
Существует несколько путей, при которых mHtt вызывает гибель клеток. К ним относят: влияние на белки-шапероны; взаимодействие с каспазами, которые участвуют в апоптозе; токсическое действие глутамина на нервные клетки; нарушение выработки энергии в клетках и влияние на экспрессию генов. Токсическое действие mHtt значительно усиливается при взаимодействии с белком RASD2 (Rhes), который образуется преимущественно в стриатуме. RASD2 вызывает сумоляцию (SUMOylation) mHtt к образованию белковых сгустков и дезагрегации — исследования в культуре клеток показали, что сгустки менее токсичны, чем дезагрегированная форма[17].
Макроскопические изменения под действием mHtt
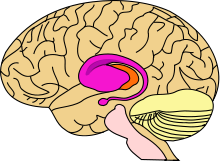 Область головного мозга, поражающаяся при болезни Хантингтона, — стриатум (фиолетовым цветом)
Область головного мозга, поражающаяся при болезни Хантингтона, — стриатум (фиолетовым цветом)
Болезнь Хантингтона поражает специфические области мозга. Наиболее заметные ранние изменения затрагивают область базальных ганглиев называемую полосатым телом, которое состоит из хвостатого ядра и скорлупы[6]. Другие повреждаемые области включают чёрную субстанцию, 3, 5 и 6 слои коры головного мозга, гиппокамп, клетки Пуркинье в мозжечке, боковые туберальные ядра гипоталамуса и часть таламуса[4]. Эти области получают повреждения в соответствии с их структурой и типами содержащихся в них нейронов, уменьшаясь в размерах в связи с гибелью клеток[4]. Звёздчатые нейроны полосатого тела наиболее уязвимы, особенно проецирующиеся в направлении поверхности бледного шара, вставочные и звёздчатые нейроны проецирующиеся к центру бледного шара получают меньше повреждений[4][18]. Болезнь Хантингтона также вызывает аномальное увеличение астроцитов[19].
Базальные ганглии — часть головного мозга, наиболее заметно повреждающиеся при болезни Хантингтона — играют ключевую роль в контроле движений и поведения. Их функция полностью не ясна, но современные теории предполагают, что они являются частью когнитивной исполнительной системы. Базальные ганглии в норме ингибируют большое число контуров (circuit), генерирующих специфические движения. Для инициации специфических движений, кора посылает сигналы базальным ганглиям для снятия ингибирования. Повреждение базальных ганглиев может привести к снятию ингибирования или его постоянным неконтролируемым изменениям, что служит причиной затруднения начала движения или к их непроизвольной инициации, или движение может быть прервано до или после достижения желаемого результата. Накапливающиеся повреждения в этой области приводят к беспорядочным движениям, характерным для болезни Хантингтона[20].
В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 31 июля 2011.Симптомы
Симптомы болезни Хантингтона могут проявиться в любом возрасте, но чаще это происходит в 35–44 года[21][22]. На ранних стадиях происходят небольшие изменения личности, когнитивных способностей и физических навыков[21]. Обычно первыми обнаруживают физические симптомы, так как когнитивные и психические расстройства не столь выражены в ранних стадиях[21]. Почти у всех пациентов болезнь Хантингтона в конечном итоге проявляется схожими физическими симптомами, но начало заболевания, прогрессирование и степень когнитивных и психических нарушений различаются у отдельных лиц[23][24].
Для начала заболевания наиболее характерна хорея — беспорядочные, неконтролируемые движения. Хорея в начале может проявляться в виде беспокойства, небольших непроизвольных или незавершённых движениях, нарушении координации и замедлении скачкообразных движений глаз[21].
В самом начале обычно возникают проблемы из-за физических симптомов, которые выражаются в резких, внезапных и не поддающихся контролю движениях. В других случаях, наоборот, больной двигается слишком замедленно. Возникают нарушения координации движений, речь становится невнятной. Постепенно все функции, требующие мышечного контроля, нарушаются: человек начинает гримасничать, испытывает проблемы с жеванием и глотанием. Из-за быстрого движения глаз происходят нарушения сна. Обычно больной проходит через все стадии физического расстройства, однако влияние болезни на когнитивные функции у всех очень индивидуально. Чаще всего происходит расстройство абстрактного мышления, человек перестаёт быть способным планировать свои действия, следовать правилам, оценивать адекватность своих действий. Постепенно появляются проблемы с памятью, может возникнуть депрессия и паника, эмоциональный дефицит, эгоцентризм, агрессия, навязчивые идеи, проблемы с узнаванием других людей, гиперсексуальность и усиление вредных привычек, таких как алкоголизм или игромания.
Диагностика
Клинические методы
Физикальное обследование, иногда в сочетании с психологическим обследованием, позволяет определить область распространения болезни[21]. Медицинская визуализация (компьютерная томография (КТ), магнитно-резонансная томография (МРТ)) показывает только видимую атрофию мозга на прогрессирующей стадии заболевания. Методы функциональной нейровизуализации (фМРТ и позитронно-эмиссионная томография (ПЭТ)) могут показать изменения в активности мозга до появления клинических симптомов[4].
Генетические методы
Для проведения генетической диагностики болезни Хантингтона необходим забор крови с последующим определением количества повторов ЦАГ в каждом НТТ аллеле[25]. Положительный результат не подтверждает диагноз, поскольку может быть получен за несколько лет до появления первых симптомов. Однако, отрицательный результат однозначно свидетельствует об отсутствии вероятности развития болезни Хантингтона[4].
Эмбрионы
Эмбрионы, полученные в результате экстракорпорального оплодотворения, могут быть подвержены генетической диагностике болезни Хантингтона с применением преимплантационной генетической диагностики. При этом методе забирается одна клетка из 4–8-клеточного эмбриона и затем проверяется на генетическую патологию. Полученная информация может впоследствии быть использована при выборе здорового эмбриона для имплантации. Кроме того, возможна пренатальная диагностика для эмбриона или плода в утробе матери[26].
Дифференциальная диагностика
Около 90% диагнозов болезни Хантингтона, основанных на обнаружении типичных симптомов и семейном анамнезе, подтверждаются генетическим тестированием. Большинство других расстройств с аналогичными симптомами называют ХГ-подобными расстройствами (англ. HD-like disorders, HDL)[27]. Причины большинства HDL заболеваний неизвестны. Известно лишь, что некоторые из них возникают в результате мутаций генов PRNP (HDL1), junctophilin 3 (HDL2), рецессивно наследуемого HTT гена (HDL3 — обнаружен у одной семьи и мало изучен) и гена, кодирующего ТАТА-связывающий белок (HDL4/SCA17)[27]. К другим заболеваниям с аутосомно-доминантным наследованием, которые схожи с болезнью Хантингтона, относят дентаторубро-паллидолюисовую атрофию и нейроферритинопатию[27].
Лечение
Болезнь Хантингтона неизлечима, но существует лечение, способное облегчить некоторые симптомы.[28]
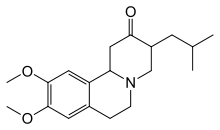
Тетрабеназин был разработан специально для уменьшения тяжести симптомов болезни Хантингтона[29], был утвержден в 2008 году в США[30]. Нейролептики и бензодиазепины помогают уменьшить проявления хореи[22]. Амантадин и ремацемид находятся в стадии исследования, но показали положительные результаты[31]. Для облегчения гипокинезии и ригидности мышц назначают противопаркинсонические лекарства, для облегчения миоклонической гиперкинезии - вальпроевую кислоту[22].
Для устранения депрессии применяют селективные ингибиторы обратного захвата серотонина и миртазапин, а при психозах и нарушениях поведения назначают атипичные антипсихотики[32].
В настоящий момент ведутся активные исследования по разработке способа лечения: Обнаружено потенциальное направление для лечения хореи Гентингтона
Прогноз
С момента появления первых симптомов продолжительность жизни составляет около 15–20 лет.
Смерть обычно происходит не из-за болезни Хантингтона, а из-за сопутствующих ей осложнений, включая пневмонию, заболевания сердца и травмы. Также частой причиной смерти является суицид.
Ссылки
- ↑ NCBI OMIM Huntington's Disease. Проверено 22 мая 2008.
- ↑ George Huntington (1850—1916) and Hereditary Chorea
- ↑ George Huntington (1850—1916) and hereditary chorea
- ↑ 1 2 3 4 5 6 7 Walker FO (2007). «Huntington's disease». Lancet 369 (9557). DOI:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ Katsuno M, Banno H, Suzuki K, et al. (2008). «Molecular genetics and biomarkers of polyglutamine diseases». Curr. Mol. Med. 8 (3): 221–34. DOI:10.2174/156652408784221298. PMID 18473821. Проверено 2009-04-01.
- ↑ 1 2 3 4 5 6 7 Walker FO (2007). «Huntington's disease». Lancet 369 (9557). DOI:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ Walker FO (2007). «Huntington's disease». Lancet 369 (9557). DOI:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ Nance MA, Myers RH (2001). «Juvenile onset Huntington's disease—clinical and research perspectives». Ment Retard Dev Disabil Res Rev 7 (3): 153–7. DOI:10.1002/mrdd.1022. PMID 11553930.
- ↑ Vessie, P. R. (1932) «On the transmission of Huntington’s chorea for 300 years—the Bures family group». Journal of Nervous and Mental Disease, Baltimore 76: 553—573.
- ↑ Wexler, A. (2008) «The Woman Who Walked into the Sea: Huntington’s and the Making of a Genetic Disease», Yale University Press; 1 edition
- ↑ Goehler H, Lalowski M, Stelzl U, et al. (2004). «A protein interaction network links GIT1, an enhancer of Huntingtin aggregation, to Huntington's disease». Mol. Cell 15 (6): 853–65. DOI:10.1016/j.molcel.2004.09.016. PMID 15383276. Проверено 2009-04-27.
- ↑ Harjes P, Wanker EE (2003). «The hunt for huntingtin function: interaction partners tell many different stories». Trends Biochem. Sci. 28 (8): 425–33. DOI:10.1016/S0968-0004(03)00168-3. PMID 12932731. Проверено 2009-04-27.
- ↑ 1 2 Cattaneo E, Zuccato C, Tartari M (2005). «Normal huntingtin function: an alternative approach to Huntington's disease». Nat. Rev. Neurosci. 6 (12): 919–30. DOI:10.1038/nrn1806. PMID 16288298.
- ↑ Rubinsztein DC, Carmichael J (2003). «Huntington's disease: Molecular basis of neurodegeneration». Expert Rev Mol Med 5 (20): 1–21. DOI:10.1017/S1462399403006549. PMID 14585171.
- ↑ 1 2 Huntingtin Protein and Protein Aggregation | HOPES - A guide to the science of Huntington's disease.(недоступная ссылка — история)
- ↑ Arrasate, M. (2004) Inclusion body formation reduces levels of mutant huntingtin and the risk of neuronal death. Nature, 431(7010):805-10.
- ↑ Subramaniam S, Sixt KM, Barrow R, Snyder SH (2009). «Rhes, a striatal specific protein, mediates mutant-huntingtin cytotoxicity». Science 324 (5932): 1327–30. DOI:10.1126/science.1172871. PMID 19498170.
- ↑ Purves D, Augustine GA, Fitzpatrick D, Hall W, LaMantia A-S, McNamara JO, Williams SM Modulation of Movement by the Basal Ganglia – Circuits within the Basal Ganglia System // Neuroscience / Purves D. — 2nd. — Sunderland, MA: Sinauer Associates, 2001. — ISBN 0-87893-742-0
- ↑ Lobsiger CS, Cleveland DW (2007). «Glial cells as intrinsic components of non-cell-autonomous neurodegenerative disease». Nat. Neurosci. 10 (11): 1355–60. DOI:10.1038/nn1988. PMID 17965655.
- ↑ Crossman AR (2000). «Functional anatomy of movement disorders» (PDF). J. Anat. 196 (Pt 4): 519–25. DOI:10.1046/j.1469-7580.2000.19640519.x. PMID 10923984.
- ↑ 1 2 3 4 5 Walker FO (2007). «Huntington's disease». Lancet 369 (9557). DOI:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ 1 2 3 Huntington Disease. genereviews bookshelf. University of Washington (19 июля 2007). Проверено 12 марта 2009.
- ↑ Kremer B Clinical neurology of Huntington's disease // Huntington's Disease – Third Edition / Bates G, Harper P, and Jones L. — Oxford: Oxford University Press, 2002. — P. 28–53. — ISBN 0-19-851060-8
- ↑ Wagle, A C; Wagle SA, Marková IS, Berrios GE (2000). «Psychiatric Morbidity in Huntington's disease.». Neurology, Psychiatry and Brain Research (8): 5–16.
- ↑ Myers RH (2004). «Huntington's disease genetics». NeuroRx 1 (2): 255–62. DOI:10.1602/neurorx.1.2.255. PMID 15717026.
- ↑ Kuliev A, Verlinsky Y (2005). «Preimplantation diagnosis: A realistic option for assisted reproduction and genetic practice». Curr. Opin. Obstet. Gynecol. 17 (2): 179–83. DOI:10.1097/01.gco.0000162189.76349.c5. PMID 15758612. Проверено 2009-04-01.
- ↑ 1 2 3 Schneider SA, Walker RH, Bhatia KP (2007). «The Huntington's disease-like syndromes: what to consider in patients with a negative Huntington's disease gene test». Nat Clin Pract Neurol 3 (9): 517–25. DOI:10.1038/ncpneuro0606. PMID 17805246. Проверено 2009-03-18.
- ↑ Frank S, Jankovic J. (2010). «Advances in the Pharmacological Management of Huntington's Disease». Drugs 70 (5): 561–71. DOI:10.2165/11534430-000000000-00000. PMID 20329804.
- ↑ Walker FO (2007). «Huntington's disease». Lancet 369 (9557). DOI:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ FDA Approves First Drug for Treatment of Chorea in Huntington's Disease. FDA Approves First Drug for Treatment of Chorea in Huntington's Disease. U.S. Food and Drug Administration (August 15, 2008). Архивировано из первоисточника 1 июня 2012. Проверено 10 августа 2008.
- ↑ Walker FO (2007). «Huntington's disease». Lancet 369 (9557). DOI:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ Bonelli RM, Wenning GK, Kapfhammer HP (2004). «Huntington's disease: present treatments and future therapeutic modalities». Int Clin Psychopharmacol 19 (2): 51–62. DOI:10.1097/00004850-200403000-00001. PMID 15076012. Проверено 2009-04-01.
Категории:- Заболевания по алфавиту
- Наследственные заболевания нервной системы
- Заболевания, ассоциирующиеся с психическими расстройствами
Wikimedia Foundation. 2010.