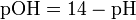- Кислая реакция
-
Водоро́дный показа́тель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
Содержание
История
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni — сила водорода, или pondus hydrogenii — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную -lgX, а буква H в данном случае обозначает концентрацию ионов водорода (H+), или, точнее, термодинамическую активность оксоний-ионов.
Уравнения, связывающие pH и pOH
Вывод значения pH
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10-7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH-] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH-] говорят, что раствор является кислым, а при [OH-] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH).
pOH
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
как в любом водном растворе при 22 °C [H + ][OH − ] = 1,0×10 − 14, очевидно, что при этой температуре:
Значения pH в растворах различной кислотности
- Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10-15 моль /л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH = −1.
Некоторые значения pH Вещество pH Электролит в свинцовых аккумуляторах <1.0 Желудочный сок 1,0—2,0 Лимонный сок 2,5±0,5 Лимонад Кола 2,5 Уксус 2,9 Яблочный сок 3,5±1,0 Пиво 4,5 Кофе 5,0 Модный шампунь 5,5 Чай 5,5 Кислотный дождь < 5,6 Кожа здорового человека ~6,5 Слюна 6,35—6,85 Молоко 6,6-6,9 Чистая вода 7,0 Кровь 7,36—7,44 Морская вода 8,0 Мыло (жировое) для рук 9,0—10,0 Нашатырный спирт 11,5 Отбеливатель (хлорка) 12,5 Раствор соды 13,5 Так как при 25 °C (стандартных условиях)[H+] · [OH-] = 10-14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислых растворах [H+] > 10-7, то pH кислых растворов pH < 7, аналогично pH щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH-); при понижении температуры, напротив, нейтральная pH возрастает.
Методы определения значения pH
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
- Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
- Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
- Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
- Влияние температуры на значения pH
0.001 мол/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3
0.001 мол/Л NaOH при 20 °C имеет pH=11.73, при 30 °C pH=10.83
Влияние температуры на значения pH объяснятеся различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
См. также
- Ионное произведение воды
- Электролитическая диссоциация
- Константа диссоциации кислот
- Гидролиз
- Индикаторы
- PH-метр
- Титрование
- Буферные растворы
- Основность
Литература
- Бейтс Р., Определение рН. Теория и практика, пер. 2 изд., Перевод с английского под редакцией акад. Б. П. Никольского и проф. М. М. Шульца. «Химия». Л., 1972
Примечания
Wikimedia Foundation. 2010.

![\mbox{pH} = -\lg \left[ \mbox{H}^+ \right]\!](/pictures/wiki/files/52/4f329e811c712bc0c8951e28ed3f150b.png)
![\mbox{pOH} = -\lg \left[ \mbox{OH}^- \right]\!](/pictures/wiki/files/100/de26f3bb8f6c0b3f10db31a4c6a97b05.png)