- Zr
-
Цирко́ний — светло-серый, блестящий металл, устойчивый к коррозии.
Цирко́ний / Zirconium (Zr) Атомный номер 40 Внешний вид простого вещества 
Свойства атома Атомная масса
(молярная масса)91,224 а. е. м. (г/моль) Радиус атома 160 пм Энергия ионизации
(первый электрон)659,7 (6,84) кДж/моль (эВ) Электронная конфигурация [Kr] 4d2 5s2 Химические свойства Ковалентный радиус 145 пм Радиус иона (+4e)79 пм Электроотрицательность
(по Полингу)1,33 Электродный потенциал 0 Степени окисления 0, +1, +2, +3, +4 Термодинамические свойства простого вещества Плотность 6,506 г/см³ Удельная теплоёмкость 0,281 Дж/(K·моль) Теплопроводность 22,7 Вт/(м·K) Температура плавления 2125 K Теплота плавления 19,2 кДж/моль Температура кипения 4650 K Теплота испарения 567 кДж/моль Молярный объём 14,1 см³/моль Кристаллическая решётка простого вещества Структура решётки гексагональная Период решётки 3,230 Å Отношение c/a 1,593 Температура Дебая 250,00 K Zr 40 91,224 4d² 5s² Цирконий Содержание
История и происхождение названия
Цирко́ний в виде двуокиси впервые был выделен в 1789 году немецким химиком М. Г. Клапротом в результате анализа минерала циркона.
Происхождение самого слова циркон неясно. Возможно, оно происходит от арабского zarkûn (киноварь) или от персидского zargun (золотистый цвет).
Нахождение в природе
Соединения циркония широко распространены в литосфере. В природе распространены главным образом циркон (ZrSiO4), бадделеит (ZrO2) и различные сложные минералы. Во всех земных месторождениях цирконию сопутствует Hf, который входит в минералы циркона благодаря изоморфному замещению атома Zr.
Циркон является самым распространенным циркониевым минералом. Он встречается во всех типах пород, но главным образом в гранитах и сиенитах. В графстве Гиндерсон (шт. Сев. Каролина) в пегматитах были найдены кристаллы циркона длиной в несколько сантиметров, а на Мадагаскаре были обнаружены кристаллы, вес которых исчисляется килограммами.
Бадделеит был найден Юссаком в 1892 г в Бразилии. Основное месторождение находится в районе Посус-ди-Калдас (Бразилия). Там была найдена глыба бадделеита весом около 30 т, а в водных потоках и вдоль обрыва бадделеит встречается в виде аллювиальной гальки диаметром до 7,5 мм, известной под названием фавас (от португальского fava — боб). Фавас обычно содержит свыше 90 % двуокиси циркония.[1]
Получение
Электролитический способ получения металлического циркония
Цирконий может быть получен электролизом галогенидов циркония в солевом расплаве. Лучшие результаты получены с электролитами, содержащими K2ZrF6, в расплаве NaCl или КС1. Электролиз проводят в ваннах состава: 20 % K2ZrF6 + 80 % NaCl или 25-30 % K2ZrF6 + 70+75 % KCl. Второй электролит имеет преимущества: напряжение разложения КС1 выше, чем NaCl, анодный эффект наступает при более высоких плотностях тока, температура плавления ниже, чем электролита с NaCl, что позволяет проводить электролиз при 750—800 °С. Приближенно процессы на катоде можно представить состоящими из диссоциации анионов (ZrF6)2- (в прикатодном пространстве) и последующего ступенчатого разряда катионов Zr4+:
(ZrF6)2- = Zr4+ + 6F- ; Zr4+ + e → Zr3+ + e → Zr2+ + 2e → Zr°
На аноде разряжаются ионы Cl-, электродный потенциал которых в солевом расплаве (+3,39 В) ниже, чем анионов F-(+3,51 В). Соответственно этому основная реакция на аноде:
4F + 4КС1 (4NaCl) — 4e = 4KF (4NaF) + 2Cl2
Однако по мере накопления в ванне фторидов на аноде происходит разряд ионов F-. Выделяющийся фтор взаимодей¬ствует с графитовым анодом, образуя CF4. Накопление фторидов происходит медленно, так как значительное количество фторида увлекается из ванны с катодным осадком. Процесс ведут при катодной плотности тока 350—450 А/дм2. Катодный осадок содержит около 30 % порошка циркония с размерами частиц 50-200 мкм. В процессе электролиза наблюдается существенная очистка циркония от гафния, так как потенциал выделения гафния ниже, чем циркония. На рис. показана схема герметичного электролизера отечественной конструкции для получения циркония. Ванна из нержавеющей стали с водяной рубашкой. На внутренних стенках образуется гарниссаж застывшего электролита, предохраняющий от загрязнения электролита железом. В ванну введены четыре графитовых электрода: два анода и два электрода переменного тока для разогрева и расплавления электролита. Катод — стальной. После отложения заданного количества металла катод с осадком извлекают через шлюз в охладительную камеру, заполненную аргоном, которую отсоединяют и к шлюзу присоединяют камеру с новым катодом, который после заполнения камеры аргоном опускают в электролит. После охлаждения в аргоне катодный осадок сбивают с катода, дробят и обрабатывают водой, 10%-нон HCI, промывают водой, спиртом и сушат в вакууме при 50—60 С. Чистота порошков характеризуется следующим примерным соста¬вом, %: N 0,003; С 0,05; О 0,06; Fe 0,013; Ni 0,07; Ti 0,002; Mn, CI < 0,002; СО < 0,05; Mg < 0,01; Si < 0,05. После переплавки в дуговой печи с расходуемым электродом слиток циркония имеет твердость НВ 1300—1400 МПа. При условии разработки конструкций больших электролизеров, в которых можно осуществить непрерывный или полунепрерывный процесс, электролитический способ получения циркония может конкурировать с магниетермическим способом восстановления из хлоридов.
МИСиС (ТУ)
Физико-химические свойства
Цирконий существует в двух кристаллических модификациях: a-формы с гексагональной плотноупакованной решёткой (а = 3,228 ; с = 5,120) и b-формы с кубической объёмноцентрированной решёткой (а = 3,61). Переход a → b происходит при 862 °C. Плотность a-циркония (20 °C) 6,45 г/см3; tпл 1825 — 10 °C; tкип 3580-3700 °C; удельная теплоёмкость (25-100 °C) 0,291 кДж/(кг×К) [0,0693 кал/(г×°C)], коэффициент теплопроводности (50 °C) 20,96 вт/(м×К) [0,050 кал/(см×сек×°C)]; температурный коэффициент линейного расширения (20-400 °C) 6,9×10-6; удельное электрическое сопротивление циркония высокой степени чистоты (20 °C) 44,1 мкОм×см. температура перехода в состояние сверхпроводимости 0,7 К. цирконий парамагнитен; удельная магнитная восприимчивость увеличивается при нагревании и при −73 °C равна 1,28×10-6, а при 327 °C — 1,41×10-6. Сечение захвата тепловых нейтронов (0,18 ? 0,004)×10-28 м², примесь гафния увеличивает это значение. Чистый цирконий пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых количеств кислорода, азота, водорода и углерода (или соединений этих элементов с цирконием) вызывает хрупкость циркония. Модуль упругости (20 °C) 97 Гн/м² (9700 кгс /мм²); предел прочности при растяжении 253 Мн/м² (25,3 кгс/мм²); твёрдость по Бринеллю 640—670 Мн/м² (64-67 кгс/мм²); на твёрдость очень сильное влияние оказывает содержание кислорода: при концентрации более 0,2 % цирконий не поддаётся холодной обработке давлением.
Внешняя электронная конфигурация атома циркония 4d²5s². Для циркония характерна степень окисления +4. Более низкие степени окисления +2 и +3 известны для циркония только в его соединениях с хлором, бромом и иодом. Компактный цирконий медленно начинает окисляться в пределах 200—400 °C, покрываясь плёнкой циркония двуокиси
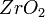 ; выше 800 °C энергично взаимодействует с кислородом воздуха. Порошкообразный металл пирофорен — может воспламеняться на воздухе при обычной температуре. Цирконий активно поглощает водород уже при 300 °C, образуя твёрдый раствор и гидриды
; выше 800 °C энергично взаимодействует с кислородом воздуха. Порошкообразный металл пирофорен — может воспламеняться на воздухе при обычной температуре. Цирконий активно поглощает водород уже при 300 °C, образуя твёрдый раствор и гидриды 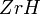 и
и 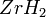 ; при 1200—1300 °C в вакууме гидриды диссоциируют и весь водород может быть удалён из металла. С азотом цирконий образует при 700—800 °C нитрид
; при 1200—1300 °C в вакууме гидриды диссоциируют и весь водород может быть удалён из металла. С азотом цирконий образует при 700—800 °C нитрид 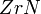 . Цирконий взаимодействует с углеродом при температуре выше 900 °C с образованием карбида
. Цирконий взаимодействует с углеродом при температуре выше 900 °C с образованием карбида 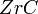 . Карбид и нитрид циркония — твёрдые тугоплавкие соединения; карбид циркония — полупродукт для получения хлорида
. Карбид и нитрид циркония — твёрдые тугоплавкие соединения; карбид циркония — полупродукт для получения хлорида 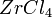 . Цирконий вступает в реакцию со фтором при обычной температуре, а с хлором, бромом и иодом при температуре выше 200 °C, образуя высшие галогениды
. Цирконий вступает в реакцию со фтором при обычной температуре, а с хлором, бромом и иодом при температуре выше 200 °C, образуя высшие галогениды 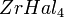 (где
(где 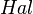 — галоген). Цирконий устойчив в воде и водяных парах до 300 °C, не реагирует с соляной и серной (до 50 %) кислотами, а также с растворами щелочей (цирконий — единственный металл, стойкий в щелочах, содержащих аммиак). С азотной кислотой и царской водкой он взаимодействует при температуре выше 100 °C. Растворяется в плавиковой и горячей концентрированной (выше 50 %) серной кислотах. Из кислых растворов могут быть выделены соли соответствующих кислот разного состава, зависящего от концентрации кислоты. Так, из концентрированных сернокислых растворов циркония осаждается кристаллогидрат
— галоген). Цирконий устойчив в воде и водяных парах до 300 °C, не реагирует с соляной и серной (до 50 %) кислотами, а также с растворами щелочей (цирконий — единственный металл, стойкий в щелочах, содержащих аммиак). С азотной кислотой и царской водкой он взаимодействует при температуре выше 100 °C. Растворяется в плавиковой и горячей концентрированной (выше 50 %) серной кислотах. Из кислых растворов могут быть выделены соли соответствующих кислот разного состава, зависящего от концентрации кислоты. Так, из концентрированных сернокислых растворов циркония осаждается кристаллогидрат 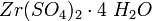 ; из разбавленных растворов — основные сульфаты общей формулы
; из разбавленных растворов — основные сульфаты общей формулы 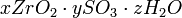 (где х: y > 1). Сульфаты циркония при 800—900 °C полностью разлагаются с образованием двуокиси циркония. Из азотнокислых растворов кристаллизуется
(где х: y > 1). Сульфаты циркония при 800—900 °C полностью разлагаются с образованием двуокиси циркония. Из азотнокислых растворов кристаллизуется 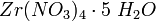 или
или 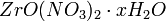 (где х = 2-6), из солянокислых растворов —
(где х = 2-6), из солянокислых растворов —  , который обезвоживается при 180—200 °C.[2]
, который обезвоживается при 180—200 °C.[2]Экономика
Стоимость циркония в конце 1990-х — 20-26$ за килограмм.[2]
Применение циркония и его соединений
В промышленности цирконий стал применяться с 30-х годов XX века. Из-за высокой стоимости его применение ограничено. Единственным предприятием, специализирующемся на производстве циркония в России (и на территории бывшего СССР)- является Чепецкий механический завод (город Глазов, Удмуртия).
Металлический цирконий и его сплавы
Ядерная энергетика
Цирконий имеет очень малое сечение захвата тепловых нейтронов. Поэтому металлический цирконий, не содержащий гафния, и его сплавы применяются в атомной энергетике для изготовления тепловыделяющих элементов, теплообменников и других конструкций ядерных реакторов.
Легирование
В металлургии применяется в качестве лигатуры. Хороший раскислитель и деазотатор, по эффективности превосходит Mn, Si, Ti. Легирование сталей цирконием (до 0,8 %) повышает их механические свойства и обрабатываемость. Делает также более прочными и жаростойкими сплавы меди при незначительной потере электропроводности.
Пиротехника
Цирконий обладает замечательной способностью сгорать в кислороде воздуха (температура самовоспламенения — 250 °C) практически без выделения дыма, с высокой скоростью и развивая наиболее высокую температуру из всех металлических горючих (4650 °C). За счет высокой температуры образующаяся двуокись циркония излучает значительное количество света, что используется очень широко в пиротехнике (производство салютов и фейерверков), производстве химических источников света применяемых в различных областях деятельности человека (факелы, осветительные ракеты, осветительные бомбы, ФОТАБ — фотоавиабомбы). В этой сфере повышеный интерес имеет не только металлический цирконий, но и его сплавы с церием (значительно больший световой поток). Порошкообразный цирконий применяют в смеси с окислителями (бертолетова соль) как бездымное средство в сигнальных огнях пиротехники и в запалах, заменяя гремучую ртуть и азид свинца.
Сверхпроводник
Сверхпроводящий сплав 75 % Nb и 25 % Zr (сверхпроводимость при 4,2 K) выдерживает нагрузку до 100 000 А/см².
Конструкционный материал
В виде конструкционного материала идет на изготовление кислотостойких химических реакторов, арматуры, насосов. Цирконий применяют как заменитель благородных металлов.
Циркон «обезжелезненный» применяется в виде различных огнеупоров для футеровки стекловаренных и металлургических печей. Он также применятся в производстве строительной керамики, эмалей и глазурей для сантехнических изделий.
Медицина
Цирконий обладает высокой стойкостью к воздействию биологических сред, даже более высокой, чем титан, и отличной биосовместимостью, благодаря чему применяется для создания костных, суставных и зубных протезов, а также хирургического инструмента.
Быт
Цирконий применяется для изготовления разнообразной посуды, обладающей отличными гигиеническими свойствами благодаря высокой химической стойкости.
Соединения
Диоксид циркония (т. пл. 2700 °C). Область применения — производство огнеупоров-бакоров (бакор — бадделеит-корундовая керамика). Применяется в качестве заменителя шамота, так как в 3—4 раза увеличивает кампанию в печах для варки стекла и алюминия. Огнеупоры на основе стабилизированной двуокиси применяются в металлургической промышленности для желобов, стаканов при непрерывной разливке сталей, тиглей для плавки редкоземельных элементов. Также применяется в керметах — керамикометаллических покрытиях, которые обладают высокой твёрдостью и устойчивостью ко многим химическим реагентам, выдерживают кратковременные нагревания до 2750 °C. Двуокись — глушитель эмалей, придает им белый и непрозрачный цвет. На основе кубической модификации двуокиси циркония, стабилизированной скандием, иттрием, редкими землями, получают материал — фианит (от ФИАНа где он был впервые получен), фианит применяется в качестве оптического материала с большим коэффициентом преломления (линзы плоские), в медицине (хирургический инструмент), в качестве синтетического ювелирного камня (дисперсия, показатель преломления и игра цвета больше, чем у бриллианта), при получении синтетических волокон, и производстве некоторых видов проволоки (волочение). При нагревании диоксид циркония проводит ток, что иногда используется для получения нагревательных элементов устойчивых на воздухе при очень высокой температуре. Нагретый цирконий способен проводить ионы кислорода как твердый электролит. Это свойство используется в промышленных анализаторах кислорода.
Диборид циркония ZrB2 — кермет. В различных смесях с нитридом тантала и карбидом кремния материал для производства резцов. Цены на металлический цирконий в 2006 году составили в среднем 120 долларов США за килограмм.
Карбид циркония (т. пл. 3530 °C) важнейший конструкционный материал для твердофазных ядерных реактивных двигателей.
Бериллид циркония чрезвычайно твёрд и устойчив к окислению на воздухе до 1650 °C, применяется в авиакосмической технике (двигатели, сопла, реакторы, радиоизотопные электрогенераторы).
Гидрид циркония применяется в качестве компонента ракетного топлива, в атомной технике как весьма эффективный замедлитель нейтронов. Также гидрид циркония служит для покрытия цирконием в виде тонких плёнок с помощью термического разложения его на различных поверхностях.
Нитрид циркония материал для керамических покрытий, Тпл около 2990 °C , гидролизуется в царской водке. Нашел применение в качестве покрытий в стоматологии и ювелирном деле.
Биологическая роль и физиологическое действие
Цирконий не играет биологической роли в организме. Жителям России памятны пресловутые циркониевые браслеты, рекламируемые В.Кикабидзе, якобы снижающие артериальное давление, но не оказывающие реального терапевтического действия.[1].
О воздействии соединений циркония на организм ничего не известно. Пыль циркония представляет собой вещество с большой пожаро- и взрывоопасностью, поскольку может самовоспламениться на воздухе.
Изотопы
В природной смеси содержится пять изотопов циркония (90Zr, 91Zr, 92Zr, 94Zr и 96Zr), причём 96Zr слабо радиоактивен (двойной бета-распад с периодом полураспада 2,4×1019 лет).
Примечания
- ↑ «Химия циркония», У. Б. Блюменталь, Москва, 1963.
- ↑ 1 2 По материалам сайта Zirconium.Ru
Wikimedia Foundation. 2010.
