- Тилакоид
-
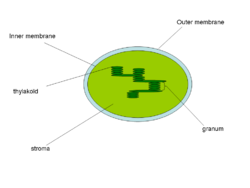
Тилакоиды — ограниченные мембраной компартменты внутри хлоропластов и цианобактерий. В тилакоидах происходят светозависимые реакции фотосинтеза. Слово «тилакоид» происходит от греческого слова thylakos, означающего «мешочек». Тилакоиды состоят из мембраны, окружающей просвет тилакоида. Тилакоиды хлоропластов часто имеют структуру, напоминающую стопку дисков. Эти стопки называют гранами (от латинского «Granum» стопка монет). Граны соединены межграновыми или строматическими тилакоидами (ламеллами) в единое функциональное пространство.Содержание
Строение тилакоида
Тилакоиды — это ограниченные мембраной структуры, расположенные в строме хлоропласта.
Мембрана
Мембрана тилакоида собственно и является тем местом, где протекают светозависимые реакции фотосинтеза. Эти реакции идут при участии фотосинтетических пигментов, расположенных непосредственно на мембране в виде перемежающихся темных и светлых полос шириной около 1 нм[1].
Липидный бислой тилакоида по свойствам схож с бактериальными мембранами, а также с внутренней мембраной хлоропласта. В его состав, например, входят кислые липиды, (также как у цианобактерий и других бактерий, способных к фотосинтезу), которые используются для поддержания функциональной целостности фотосистемы[2].
Мембраны тилакоидов у высших растений в основном состоят из фосфолипидов[3] и галактолипидов, которые распределены по мембране неравномерно[4].
Процесс синтеза липидов для тилакоидной мембраны довольно сложен, он включает в себя обмен предшественниками липидов между эндоплазматическим ретикулумом и внутренней мембраной оболочки пластиды, откуда сами липиды передаются на тилакоиды через транспорт везикул[5].
Просвет
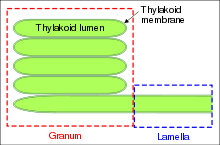
Просвет тилакоида (люмен) — это компартмент, ограниченный тилакоидной мембраной. Он играет существенную роль в фотофосфорилировании в процессе фотосинтеза. Во время протекания светозависимых реакций протоны накачиваются через мембрану тилакоида в его люмен. pH просвета при этом может снижаться до 4.
Граны
Граны — это стопки из тилакоидов, имеющих форму дисков. Хлоропласты могут содержать от 10 до 100 гран. Граны соединены строматическими тилакоидами, которые иногда называют также межграновыми тилакоидами, или ламеллами. Грановые и межграновые тилакоиды различаются своим белковым составом.
Образование тилакоидов
Хлоропласты развиваются из пропластид, когда росток поднимается над поверхностью почвы. Для образование тилакоидов обязательно наличие света. В зародыше растения, равно как и в отсутствие света, пропластиды превращаются в этиопласты, обладающие полукристаллическими мембранами, которые называют проламеллярными телами. Под воздействием света эти проламеллярные тела превращаются в тилакоиды. Это, однако, не происходит у ростков, прорастающих в темноте; такие ростки подвергаются этиоляции. Недостаточная освещенность может привести к нарушению формирования тилакоидов. Это приводит к нефункциональности хлоропластов и в результате — к гибели растения.
Для образования тилакоидов также требуется белок VIPP1 (белок пластид 1, индуцирующий везикулярный транспорт, англ. vesicle-inducing protein in plastids 1). Растение погибает без этого белка, а его сниженная концентрация замедляет рост растения и вызывает его бледную окраску, а также снижает фотосинтетическую активность. VIPP1 требуется для формирования собственно тилакоидной мембраны, но не для сборки белковых комплексов на этой мембране[6].
Этот белок очень консервативен у всех организмов, содержащих тилакоиды, даже у сине-зелёных водорослей,[7] зеленых водорослей, например, хламидомонады[8] и высших растений, таких как арабидопсис [9].
Выделение и фракционирование тилакоидов
Тилакоиды могут быть выделены из растительной клетки при помощи комбинации дифференциального и градиентного центрифугирования[10]. Разрушение выделенных тилакоидов, например, за счет механического воздействия, позволяет выделить вещество люмена. Из оставшихся фрагментов мембраны можно извлечь также поверхностные и интегральные белки: обработка карбонатом натрия (Na2CO3) вызывает отделение поверхностных мембранных белков, тогда как обработка детергентами и органическими растворителями позволяет извлечь и интегральные мембранные белки.
Белки тилакоидов
Тилакоиды содержат множество интегральных и поверхностных мембранных белков. Много белков содержится и в веществе люмена. Недавние протеомные исследования[11] тилакоидных фракций позволили накопить много информации по белковому составу тилакоидов. Эти данные обобщены в нескольких базах данных по пластидным белкам, доступных в Интернете[12][13].
Как показали упомянутые исследования, протеом тилакоида состоит, как минимум, из 335 различных белков. 89 из них содержатся в веществе люмена, 116 — интегральные мембранные белки, 68 — на поверхности внутренней мембраны (со стороны люмена), и 62 — поверхностные на внешней мембране (со стороны стромы хлоропласта). Кроме того, с помощью компьютерных методов предсказаны дополнительные редкие белки вещества люмена[14][10]. Из тилакоидных белков с известными функциями 42 % участвует в фотосинтезе. 11 % задействовано в транспорте, обработке и в поддержке фолдинга белков, 9 % — в реакции на окислительный стресс, и в 8 % — в трансляции[12].
Интегральные мембранные белки
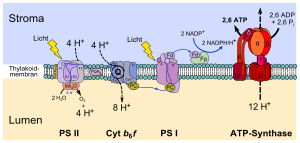
Тилакоидные мембраны содержат интегральные белки, играющие важную роль в захвате светового фотона и в светозависимых фотосинтетических реакциях. На мембране есть четыре основных белковых комплекса:
- фотосистемы I и II
- Цитохромный комплекс b6f
- АТФ-синтаза
Фотосистема II в основном встречается у грановых тилакоидов, тогда как фотосистема I и АТФ-синтаза — у строматических тилакоидов, а также у внешних слоев гранов. Цитохромный комплекс b6f распределен равномерно по всей мембране.
Поскольку две фотосистемы пространственно разделены на тилакоидной мембране, для обмена электронами между ними необходимы подвижные переносчики. В роли таких переносчиков выступают пластохинон и пластоцианин. Пластохинон переносит электроны от фотосистемы II к цитохромному комплексу b6f, тогда как пластоцианин переносит их от цитохромного комплекса b6f к фотосистеме I.
Все вместе эти белки преобразуют энергию света для работы электронтранспортных цепей, которые создают электрохимический потенциал через тилакоидную мембрану, а также синтезируют фосфат никотинамид-аденинового динуклеотида (НАДФ) — продукт конечной окислительно-восстановительной реакции. АТФ-синтаза использует этот электрохимический потенциал для синтеза АТФ в процессе фотофосфорилирования.
Фотосистемы
Фотосистемы тилакоида — центры осуществления окислительно-восстановительных светозависимых реакций. Каждая фотосистема содержит антенный комплекс, который улавливает свет различных длин волн с использованием хлорофилла и вспомогательных фотосинтетических пигментов, таких как каротиноиды и фикобилипротеины. На антенном комплексе имеется от 250 до 400 молекул пигмента. Поглощаемая ими энергия за счет резонансного переноса передается специализированному хлорофиллу a, расположенному в реакционном центре каждой фотосистемы. Когда любая из двух молекул хлорофилла a в реакционном центре получает энергию, электрон передается молекуле-акцептору.
Реакционный центр Фотосистемы I наиболее эффективно поглощает свет на длине волны 700 нм. Он содержит две молекулы хлорофилла a, обозначаемые P700. Фотосистема II содержит хлорофилл P680, максимум поглощения которого приходится на 680 нм (следует отметить, что обе эти длины волны лежат глубоко в красной области спектра, см. статью про видимый свет). В обозначениях хлорофиллов P — сокращение от «пигмент», а число показывает длину волны в нанометрах, на которой достигается максимум поглощения света.
Цитохромный комплекс b6f
Цитохромный комплекс b6f входит в электронтранспортную цепь тилакоида и соединяет передачу электронов с прокачкой протонов в просвет тилакоида. В цепочке переносчиков он расположен между двумя фотосистемами и передает электроны от пластохинона фотосистемы II к пластоцианину фотосистемы II.
АТФ-синтаза
Тилакоидная АТФ-синтаза — это АТФ-синтаза CF1FO, похожая на митохондриальную АТФ-синтазу. Она интегрирована в мембрану тилакоида, причем ее компонент CF1 выступает в строму хлоропласта. Таким образом АТФ синтезируется на стромальной стороне тилакоида, где он необходим для светонезависимых реакций фотосинтеза.
Белки люмена
В люмене тилакоида содержится белок пластоцианин, осуществляющий транспорт электронов от цитохромного белкового комплекса b6f к фотосистеме I. В отличие от липидорастворимого пластохинона, который может перемещаться по мембране тилакоида, пластоцианин гидрофилен и перемещается в веществе люмена.
В люмене тилакоидов также происходит расщепление воды. Эту операцию выполняет водорасщепляющий комплекс, связанный с участком фотосистемы II, выступающим в люмен.
Белки люмена могут быть предсказаны на основании анализа их сигнальных последовательностей. У арабидопсиса была предсказана большая группа белков, имеющих сигнал «TAT», из них примерно 19 % задействована в обработке белков (протеолизе и сворачивании), 15 % в фотосинтезе, 11 % в метаболизме и 7 % в окислительно-восстановительных реакциях и защите от инфекции[10].
Экспрессия тилакоидных белков
Хлоропласты обладают собственным геномом, в котором хранятся гены некоторых тилакоидных белков. Однако в процессе эволюции пластид из их предшественников — эндосимбиотических цианобактерий — произошел перенос большого количества генов из хлоропластного генома в ядро клетки. В результате этого четыре основных тилакоидных белковых комплекса частично кодируются в геноме хлоропласта, а частично — ядерным геномом.
Растения выработали несколько механизмов совместной регуляции экспрессии белков, входящих в эти комплексы, гены которых хранятся в разных органеллах, чтобы достичь необходимой стехиометрии и необходимого качества сборки белковых комплексов. Например транскрипция ядерных генов, кодирующих части фотосинтетического аппарата, зависит от освещенности.
Жизненный цикл тилакоидных белковых комплексов управляется фосфорилированием специфическими киназами, чувствительными к окислению и восстановлению, которые располагаются на тилакоидных мембранах[15].
Скорость трансляции белков, кодируемых в геноме хлоропластов, контролируется присутствием или отсутствием сборочных белков[16]. Этот механизм содержит отрицательную обратную связь, реализуемую связыванием вспомогательного белка с 5'-концом нетранслированного участка хлоропластной мРНК [17].
Кроме того, хлоропласты должны поддерживать баланс между концентрациями фотосистем I и II для нормального функционирования электронтранспортной цепи. Состояние (окисленное/неокисленное) носителя электронов пластохинона на тилакоидной мембране непосредственно контролирует транскрипцию хлоропластных генов, кодирующих белки реакционных центров фотосистем, компенсируя разбалансировку электронтранспортной цепи[18].
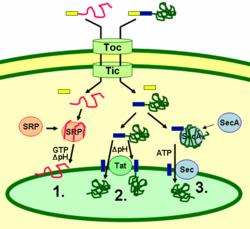
Транспорт белков в тилакоидах
Белки тилакоидов направляются к местам их расположения при помощи сигнальных пептидов и механизмов секреции, похожих на прокариотические. Большинство белков тилакоидов, кодируемых ядерным геномом растения для нахождения места своего назначения нуждаются в двух сигналах: N-концевом хлоропластном маркере (показан на рисунке желтым), и тилакоидном маркере (показан синим). Белки вводятся в хлоропласт через транслоконные комплексы на внутренней и внешней мембранах (на рисунке — Tic и Toc).
После попадания внутрь хлоропласта первый маркер отщепляется протеазой, которая обрабатывает входящие белки. Это открывает доступ ко второму сигналу, и белок из стромы хлоропласта переносится в тилакоид в рамках второго этапа транспортировки. Этот второй этап требует работы компонентов тилакоида, ответственных за перенос белков, и происходит с затратами энергии.
Белки интегрируются в мембрану через механизм распознавания сигнальных участков (1), через механизм диаргининовой транслокации (ДАТ) (2) либо самопроизвольно за счет наличия в них трансмембранных доменов (на рисунке не показано). Белки вещества просвета переносятся в просвет через мембрану тилакоида через механизм ДАТ (2) либо через секреторный механизм (3), и высвобождаются за счет отщепления тилакоидного маркера.
Разные механизмы переноса белков используют разные сигнальные пептиды и источники энергии. Секреторный механизм в качестве источника энергии использует АТФ и реализуется маркером SecA, связывающимся с переносимым белком, и секреторным мембранным комплексом Sec, непосредственно осуществляющем перенос.
Белки с двумя аргининами в их тилакоидном сигнальном маркере переносятся с помощью ДАТ, который реализуется мембранным комплексом Tat (от англ. twin arginine translocation), использующим градиент pH в качестве источника энергии.
Некоторые другие белки интегрируются в мембрану при помощи механизма распознавания сигнальных пептидов. Хлоропластные белки-рецепторы могут распознавать целевые белки как после их трансляции, так и во время ее, и таким образом они могут переносить как внешние белки, так и белки, транслируемые внутри хлоропласта. Этот механизм в качестве источников энергии использует ГТФ и градиент pH.
Некоторые трансмембранные белки могут также самопроизвольно интегрироваться в мембрану со стороны стромы без затрат энергии[19].
Функции тилакоидов
В тилакоидах осуществляются следу светозависимые реакции фотосинтеза:
- Светозависимое расщепление воды, в результате которого происходит синтез молекул кислорода;
- Перенос протонов через тилакоидную мембрану, связанный с электронтранспортной цепью фотосистем и цитохромного комплекса b6f;
- Синтез АТФ, выполняемый АТФ-синтазой с использованием протонного градиента.
Фотолиз воды
Первый этап фотосинтеза — это расщепление воды под воздействием света. Эта реакция поставляет электроны для фотосинтетических электронтранспортных цепей, а также протоны для создания протонного градиента. Реакция расщепления воды происходит на стороне тилакоидной мембраны, обращённой к люмену, и происходит с затратами энергии, полученной фотосистемами от солнечного света. Интересно отметить, что это окисление (расщепление) воды происходит с выделением O2 как побочного продукта, который сбрасывается в атмосферу и затем может быть использован другими организмами для дыхания.
Электронтранспортная цепь
В процессе фотосинтеза использованы две разновидности транспорта электроннов:
- Нециклический электронный транспорт или нециклическое фотофосфорилирование, при котором производится NADPH, протоны H+ и АТФ;
- Циклический электронный транспорт или циклическое фотофосфорилирование, при котором производится только АТФ.
Нециклическая разновидность транспорта задействует обе фотосистемы, тогда как циклическая происходит только с использованием фотосистемы I.
- Фотосистема I использует энергию света для восстановления NADP+ до NADPH + H+. Она активна в обеих разновидностях электронного транспорта. В циклическом режиме возбужденный электрон отправляется по цепочке, которая в конце возвращает его обратно к хлорофиллу, который сообщил ему энергию возбуждения.
- Фотосистема II использует энергию света для расщепления молекул воды с выходом электронов (e−), протонов (H+) и молекулярного кислорода (O2). Она задействована только в нециклическом транспорте. Электроны в добываются этой системой из окисленного 2H2O (O2 + 4 H+ + 4 e−) и удаляются из нее с NADP+, когда он восстанавливается до NADPH.
Электрохимический потенциал
Основанной функцией тилакоидной мембраны и ее интегральных фотосистем является создание электрохимического потенциала. Переносчики электронов, участвующие в электронном транспорте, используют некоторую часть энергии электронов для перекачки протонов из стромы в просвет тилакоида. Во время фотосинтеза вещество люмена приобретает кислую реакцию вплоть до pH 4 (тогда как строма имеет pH 8). Это соответствует 10 000-кратному градиенту концентрации протонов поперек тилакоидной мембраны.
Источник протонного градиента
Протоны в просвет поступают из трех источников:
- Фотолиз воды, осуществляемый фотосистемой II, в процессе которого вода в люмене тилакоида окисляется с выходом молекулярного кислорода, протонов и электронов.
- Передача электрона от фотосистемы II к пластохинону во время светозависимой реакции фотосинтеза, входящей в нециклическую электронтранспортную цепь, потребляет два протона из стромы. Они переносятся в просвет тилакоида, когда восстановленный пластохинон окисляется цитохромным комплексом b6f на стороне тилакоидной мембраны, обращенной к просвету. От пластохинона электроны передаются цитохромному комплексу b6f, который напоминает цитохром bc1.
- Восстановление пластохинона ферредоксином в процессе циклического электронного транспорта также вызывает перенос двух протонов из стромы в просвет тилакоида.
Протонный градиент также поддерживается потреблением протонов в строме при восстановлении NADP+ до NADPH, осуществляемом NADP-редуктазой.
Синтез АТФ
Молекулярный механизм синтеза АТФ в хлоропластах похож на аналогичный механизм в митохондриях. Он получает необходимую энергию от протон-движущей силы (ПДС). Однако хлоропласты используют большей частью на электрохимический потенциал ПДС. ПДС слагается из химического потенциала протонов (обусловленного градиентом их концентрации) и трансмембранного электрического потенциала (обусловленного распределением зарядов по разные стороны мембраны).
По сравнению с внутренними мембранами митохондрий, которые обладают существенно более высоким мембранным потенциалом, обусловленным разделением зарядов, градиент заряда на тилакоидных мембранах невелик. В то же время это компенсируется 10000-кратным градиентом концентрации протонов, который гораздо выше, нежели 10-кратный у митохондрий. Общий электрохимический потенциал между просветом тилакоида и стромой достаточно велик, чтобы подпитывать работу АТФ-синтазы. Когда протоны выходят обратно в строму в область сниженной концентрации через канал в АТФ-синтазе, происходит реакция синтеза АТФ. Именно через протонный градиент светозависимые реакции соединены с синтезом АТФ.
Мембраны тилакоидов цианобактерий
Цианобактерии — фотосинтетические прокариоты, обладающие высокодифференцированными мембранными системами. У этих бактерий имеется внутренняя система тилакоидных мембран, на которых расположены все компоненты действующих электронтранспортных цепей фотосинтеза и дыхания. Для цианобактерий характрено наличие на внешней стороне мембран тилакоидов сложных белковых комплексов — фикобилисом, которые состоят в основном из белков-фикобилинов фикоцианина и фикоэритрина [1]. Из эукариот фикобилисомы есть у красных водорослей и глаукофитовых. Фикобилины поглощают световую энергию и передают её к хлорофиллу а фотосистемы II.
За счет наличия таких систем фотосинтетический аппарат этих бактерий сложнее, чем у других групп фотобактерий. Им нужно уметь управлять этими мембранами, синтезировать специфические мембранные липиды, а также обеспечивать правильный транспорт белков. Плазматическая мембрана, окружающая клетку, и мембраны тилакоидов играют разные роли в клетках цианобактерий. Организация, функции, состав и динамика белков мембранных систем остается одной из наиболее активно изучаемых областей в биологии цианобактерий[20].
См. также
Ссылки
- ↑ «Photosynthesis» McGraw Hill Encyclopedia of Science and Technology, 10th ed. 2007. Vol. 13 p. 469
- ↑ Sato N (2004). «Roles of the acidic lipids sulfoquinovosyl diacylglycerol and phosphatidylglycerol in photosynthesis: their specificity and evolution». J Plant Res 117: 495–505. DOI:10.1007/s10265-004-0183-1. PMID 15538651.
- ↑ «photosynthesis.»Encyclopædia Britannica. 2008. Encyclopædia Britannica 2006 Ultimate Reference Suite DVD 9 Apr. 2008
- ↑ Spraque SG (1987). «Structural and functional organization of galactolipids on thylakoid membrane organization». J Bioenerg Biomembr 19: 691–703. DOI:10.1007/BF00762303. PMID 3320041.
- ↑ Benning C, Xu C, Awai K (2006). «Non-vesicular and vesicular lipid trafficking involving plastids». Curr Opin Plant Biol 9: 241–7. DOI:10.1016/j.pbi.2006.03.012. PMID 16603410.
- ↑ Aseeva E, Ossenbühl F, Sippel C, Cho W, Stein B, Eichacker L, Meurer J, Wanner G, Westhoff P, Soll J, Vothknecht U (2007). «Vipp1 is required for basic thylakoid membrane formation but not for the assembly of thylakoid protein complexes». Plant Physiol Biochem 45 (2): 119–28. DOI:10.1016/j.plaphy.2007.01.005. PMID 17346982.
- ↑ Westphal S, Heins L, Soll J, Vothknecht U (2001). «Vipp1 deletion mutant of Synechocystis: a connection between bacterial phage shock and thylakoid biogenesis?». Proc Natl Acad Sci U S A 98 (7): 4243–8. DOI:10.1073/pnas.061501198. PMID 11274448.
- ↑ Liu C, Willmund F, Golecki J, Cacace S, Heß B, Markert C, Schroda M (2007). «The chloroplast HSP70B-CDJ2-CGE1 chaperones catalyse assembly and disassembly of VIPP1 oligomers in Chlamydomonas». Plant J Epub ahead of print. PMID 17355436.
- ↑ Kroll D, Meierhoff K, Bechtold N, Kinoshita M, Westphal S, Vothknecht U, Soll J, Westhoff P (2001). «VIPP1, a nuclear gene of Arabidopsis thaliana essential for thylakoid membrane formation». Proc Natl Acad Sci U S A 98 (7): 4238–42. DOI:10.1073/pnas.061500998. PMID 11274447.
- ↑ 1 2 3 Peltier J, Emanuelsson O, Kalume D, Ytterberg J, Friso G, Rudella A, Liberles D, Söderberg L, Roepstorff P, von Heijne G, van Wijk K (2002). «Central functions of the lumenal and peripheral thylakoid proteome of Arabidopsis determined by and a sex tool experimentation and genome-wide prediction». Plant Cell 14 (1): 211–36. DOI:10.1105/tpc.010304. PMID 11826309.
- ↑ van Wijk K (2004). «Plastid proteomics». Plant Physiol Biochem 42 (12): 963–77. DOI:10.1016/j.plaphy.2004.10.015. PMID 15707834.
- ↑ 1 2 Friso G, Giacomelli L, Ytterberg A, Peltier J, Rudella A, Sun Q, Wijk K (2004). «In-depth analysis of the thylakoid membrane proteome of Arabidopsis thaliana chloroplasts: new proteins, new functions, and a plastid proteome database». Plant Cell 16 (2): 478–99. DOI:10.1105/tpc.017814. PMID 14729914.- The Plastid Proteome Database
- ↑ Kleffmann T, Hirsch-Hoffmann M, Gruissem W, Baginsky S (2006). «plprot: a comprehensive proteome database for different plastid types». Plant Cell Physiol 47 (3): 432–6. DOI:10.1093/pcp/pcj005. PMID 16418230. — Plastid Protein Database
- ↑ Peltier J, Friso G, Kalume D, Roepstorff P, Nilsson F, Adamska I, van Wijk K (2000). «Proteomics of the chloroplast: systematic identification and targeting analysis of lumenal and peripheral thylakoid proteins». Plant Cell 12 (3): 319–41. DOI:10.1105/tpc.12.3.319. PMID 10715320.
- ↑ Vener AV, Ohad I, Andersson B (1998). «Protein phosphorylation and redox sensing in chloroplast thylakoids». Curr Opin Plant Biol 1 (3): 217–23. DOI:10.1016/S1369-5266(98)80107-6. PMID 10066592.
- ↑ Choquet Y, Wostrikoff K, Rimbault B, Zito F, Girard-Bascou J, Drapier D, Wollman F (2001). «Assembly-controlled regulation of chloroplast gene translation». Biochem Soc Trans 29 (Pt 4): 421–6. DOI:10.1042/BST0290421. PMID 11498001.
- ↑ Minai L, Wostrikoff K, Wollman F, Choquet Y (2006). «Chloroplast biogenesis of photosystem II cores involves a series of assembly-controlled steps that regulate translation». Plant Cell 18 (1): 159–75. DOI:10.1105/tpc.105.037705. PMID 16339851.
- ↑ Allen J, Pfannschmidt T (2000). «Balancing the two photosystems: photosynthetic electron transfer governs transcription of reaction centre genes in chloroplasts». Philos Trans R Soc Lond B Biol Sci 355 (1402): 1351–9. DOI:10.1098/rstb.2000.0697. PMID 11127990.
- ↑ Gutensohn M, Fan E, Frielingsdorf S, Hanner P, Hou B, Hust B, Klösgen R (2006). «Toc, Tic, Tat et al.: structure and function of protein transport machineries in chloroplasts». J. Plant Physiol. 163 (3): 333–47. DOI:10.1016/j.jplph.2005.11.009. PMID 16386331.
- ↑ Herrero A and Flores E (editor). The Cyanobacteria: Molecular Biology, Genomics and Evolution. — 1st ed.. — Caister Academic Press, 2008. — ISBN ISBN 978-1-904455-15-8
Источники
- Heller, H. Craig; Orians, Gordan H.; Purves, William K.; & Sadava, David LIFE: The Science of Biology (seventh edition). — Sinauer Associates, Inc., 2004. — ISBN ISBN 0-7167-9856-5
- Raven Peter H. Biology of Plants, 7th Edition. — New York: W.H. Freeman and Company Publishers. — P. 115-127. — ISBN 0-7167-1007-2
- Herrero A and Flores E (editors). The Cyanobacteria: Molecular Biology, Genomics and Evolution. — 1st ed.. — Caister Academic Press, 2008. — ISBN 978-1-904455-15-8
Категории:- Фотосинтез
- Органеллы
- Мембранная биология
Wikimedia Foundation. 2010.