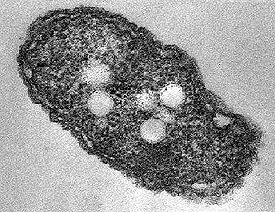
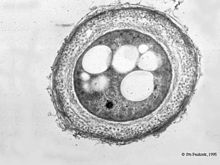
- Азотобактер
-
Азотобактер Научная классификация Царство: Бактерии Тип: Протеобактерии Класс: Gamma Proteobacteria Порядок: Pseudomonadales Семейство: Pseudomonadaceae Род: Азотобактер Латинское название Azotobacter Beijerinck, 1901 Виды - Azotobacter armeniacus
- Azotobacter beijerinckii
- Azotobacter chroococcumtypus
- Azotobacter nigricans
- Azotobacter salinestris
- Azotobacter vinelandii
ITIS 118 NCBI 352 Азотобактер (лат. Azotobacter) — род бактерий, живущих в почве и способных в результате процесса азотфиксации переводить газообразный азот в растворимую форму, доступную для усваивания растениями.
Род азотобактер принадлежит к грамотрицательным бактериям и входит в группу так называемых свободноживущих азотфиксаторов. Представители рода обитают в нейтральных и щелочных почвах[1][2], воде и в ассоциации с некоторыми растениями[3][4]. Образуют особые покоящиеся формы — цисты.
Играет важную роль в круговороте азота в природе, связывая недоступный растениям атмосферный азот и выделяя связанный азот в виде ионов аммония в почву. Используется человеком для производства азотных биоудобрений, является продуцентом некоторых биополимеров.
Первый представитель рода, Azotobacter chroococcum, был открыт и описан в 1901 году голландским микробиологом и ботаником Мартином Бейеринком. На данный момент в род входят шесть видов.
Содержание
Биологические свойства
Морфология
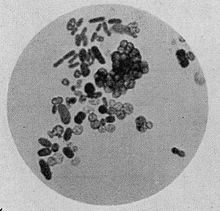 Клетки представителей рода Azotobacter: видны палочковидные и кокковидные клетки различного размера, окраска железным гематоксилином по Гейденгайну, × 1000
Клетки представителей рода Azotobacter: видны палочковидные и кокковидные клетки различного размера, окраска железным гематоксилином по Гейденгайну, × 1000
Клетки бактерий рода Azotobacter относительно крупные (1—2 мкм в диаметре), обычно овальные, но обладают плеоморфизмом, то есть могут иметь разную форму — от палочковидной до сферической. На микроскопических препаратах клетки могут располагаться одиночно, парами, неправильными скоплениями или, изредка, цепочками различной длины. Формируют особые покоящиеся формы — цисты, не образуют спор.
В свежих культурах клетки подвижны за счёт многочисленных жгутиков.[5] В более поздних культурах клетки теряют подвижность, приобретают почти кокковидную форму и продуцируют толстый слой слизи, формирующий капсулу клетки. На форму клетки также оказывает влияние химический состав питательной среды — пептон, например, вызывает плеоморфизм и, в том числе, индуцирует образование так называемых «грибоподобных» клеток. Индуцирующее влияние на плеоморфизм в культурах представителей рода азотобактер в составе пептона оказывает аминокислота глицин.[6]
При микроскопии в клетках наблюдаются включения, часть из которых окрашивается, а часть остаётся бесцветными. В начале XX века считалось, что прокрашиваемые включения являются «репродуктивными гранулами», или гонидиями, и принимают участие в размножении клетки, являясь своеобразными «зародышевыми» клетками[7], однако затем было доказано, что гранулы не принимают участия в размножении клеток и не являются «малыми, коккоподобными репродуктивными клетками» бактерий — гонидиями[8]. Прокрашиваемые гранулы состоят из волютина, неокрашивающиеся же гранулы являются каплями жира. Гранулы являются резервным источником питания.[9]
Цисты
Цисты представителей рода Azotobacter более устойчивы к действию неблагоприятных факторов внешней среды, чем вегетативные клетки — так, цисты в два раза более устойчивы к действию ультрафиолетового излучения чем вегетативные клетки, устойчивы к высушиванию, гамма-излучению, солнечной иррадиации, действию ультразвука, однако не являются устойчивыми к действию высоких температур.[10]
Формирование цист индуцируется изменением концентрации питательных веществ в питательной среде и добавлением некоторых органических веществ (например этанола, н-бутанола и β-гидроксибутирата). Цисты редко образуются в жидких питательных средах.[11] Инцистирование может быть индуцированно химическими факторами и сопровождается метаболическими сдвигами, изменениями в катаболизме и дыхании, изменениями в биосинтезе макромолекул.[12] Определённое значение в индукции инцистирования имеет альдегиддегидрогеназа[13], а также регулятор ответа AlgR[14].
Циста азотобактера — сферическое тело, состоящее из так называемого центрального тела: уменьшенной копии вегетативной клетки с большим количеством вакуолей, и двуслойной оболочки, внутренняя часть которой называется интима и имеет волокнистое строение[15], а внешняя называется экзина и представлена ровной, отражающей структурой, имеющей гексагональное кристаллическое строение[16]. Экзина частично гидролизуется трипсином и устойчива к действию лизоцима, в отличие от центрального тела.[17] Центральное тело может быть изолированно в жизнеспособном состоянии некоторыми хелатирующими агентами.[18] Главными компонентами внешней оболочки цисты являются алкилрезорцинолы, состоящие из длинных алифатических цепей и ароматических колец. Алкилрезорцинолы встречаются также у других бактерий, животных и растений.[19]
Прорастание цист
Циста представителей рода Azotobacter является покоящейся формой вегетативной клетки, необходимой для переживания неблагоприятных факторов внешней среды, и не служит для размножения. После возобновления оптимальных условий, таких, как оптимальное значение pH, температуры и поступления доступного источника углерода цисты прорастают, образовавшаяся вегетативная клетка вновь размножается путём простого деления клетки. При прорастании цист экзина цисты повреждается, и высвобождается большая вегетативная клетка.
Микроскопически первым проявлением прорастания спор является постепенным понижением преломления света цистами при фазово-контрастной микроскопии. Прорастание цист — медленный процесс и длится около 4—6 часов, на протяжении которых центральное тело увеличивается и происходит захват гранул волютина, прежде находившихся в интиме. Затем экзина лопается и вегетативная клетка высвобождается из экзины, имеющей характерную подковообразную форму.[20] При прорастании цисты отмечаются метаболические изменения. Сразу после прибавления источника углерода к среде цисты начинают поглощать кислород и выделять двуокись углерода, скорость дыхания повышается до максимальных значений через 4 часа после прибавления глюкозы. Синтез белков и РНК также начинается после прибавления источника углерода к среде, однако интенсификация синтеза макромолекул отмечается лишь через 5 часов после прибавления источника углерода. Синтез ДНК и фиксация азота инициируются через 5 часов после прибавления глюкозы к безазотистой питательной среде.[21]
Во время прорастания цист отмечаются изменения в интиме, видимые на электронно-микроскопических препаратах. Интима состоит из углеводов, липидов и белков и занимает почти такой же объём в клетке, что и центральное тело. Во время прорастания цист интима гидролизируется и используется клеткой для синтеза компонентов клетки.[22]
Физиологические свойства
Получают энергию в ходе окислительно-восстановительных реакций, используя в качестве донора электоронов органические соединения. Для роста необходим кислород, но способны расти при пониженных концентрациях кислорода, образуют каталазу и оксидазу. Способны использовать различные углеводы, спирты и соли органических кислот в качестве источников углерода. Азотфиксаторы способны фиксировать по крайней мере 10 мкг азота на грамм потреблённой глюкозы, фиксация азота зависит от наличия ионов молибдена, отсутствие молибдена может быть частично замещено ионами ванадия. В качестве источников азота могут использовать нитраты, ионы аммония и аминокислоты. Оптимум pH для роста и фиксации азота 7,0—7,5, способны расти в диапазоне pH от 4,8 до 8,5.[23] Возможен также зависимый от водорода миксотрофный рост представителей рода Azotobacter на безазотистой питательной среде, содержащей маннозу. Водород доступен в почве, поэтому не исключена возможность миксотрофии у представителей рода Azotobacter в природных условиях.[24]
Культуральные свойства
Представители рода Azotobacter способны использовать углеводы (например маннит, сахарозу, глюкозу), спирты (в том числе этанол и бутанол) и соли органических кислот, в том числе и бензоаты, в качестве источника углерода и энергии. Представители рода растут на безазотистых средах, предназначенных для выделения свободноживущих азотфиксирующих и олигонитрофильных организмов, например на среде Эшби, содержащей источник углерода (маннит, сахароза или глюкоза) и необходимые микроэлементы (источник фосфора, серы и т. д.), или на среде М. В. Фёдорова, содержащей больше микроэлементов[25], а также на жидкой среде Бейеринка.
На плотных питательных средах представители рода образуют плоские, слизистые колонии пастообразной консистенции диаметром 5—10 мм, в жидких питательных средах образуют плёнки. Характерно также пигментирование, колонии представителей рода могут быть окрашены в тёмно-коричневый, зелёный и других цветов, или же могут быть бесцветными в зависимости от видовой принадлежности. Представители рода Azotobacter являются мезофильными микроорганизмами и растут при температуре 20—30 °C.[26]
Пигменты
Представители рода Azotobacter продуцируют пигменты. Например, типовой вид рода Azotobacter chroococcum продуцирует тёмно-коричневый водорастворимый пигмент (в видовом эпитете как раз отражена эта способность) меланин. Продукция меланина у Azotobacter chroococcum наблюдается при высоких уровнях дыхания во время фиксации азота и, предположительно, также защищает нитрогеназную систему от действия кислорода при аэроадаптации[27] Другие виды рода Azotobacter также продуцируют пигменты от жёлто-зелёного до пурпурного цвета.[28] Также представители рода способны продуцировать зеленоватый флюоресцирующий пигмент, флюоресцирующий жёлто-зелёным светом и пигмент, флюоресцирующий бело-голубым светом.[29]
Геном
Частично завершено определение нуклеотидной последовательности хромосомы Azotobacter vinelandii штамма AvOP. Хромосома Azotobacter vinelandii — кольцевая молекула ДНК размером 5 342 073 пар нуклеотидов и содержит 5043 генов, из которых 4988 кодируют белки, доля Г+Ц пар составляет 65 моль %.[30] Отмечено изменение плоидности представителей рода Azotobacter на протяжении жизненного цикла: по мере старения культур количество хромосом в клетках и содержание ДНК увеличивается — в стационарной фазе роста культуры могут содержать более 100 копий хромосомы на клетку. При пересеве на свежую питательную среду первоначальное содержание ДНК (одна копия) восстанавливается[31] Кроме хромосомальной ДНК, у представителей рода Azotobacter обнаружены плазмиды[32], доказана и возможность трансформации представителей рода Azotobacter экзогенной плазмидной ДНК[33].
Распространение
Представители рода Azotobacter распространены повсеместно в нейтральных и слабощелочных почвах и не выделяются из кислых почв.[34] Были они обнаружены и в экстремальных условиях почв северного и южного полярного региона, несмотря на короткие местные сезоны роста и относительно низкие значения pH, — в арктическом регионе в глине и суглинках (в том числе торфянистых и песчанистых суглинках), в антарктическом регионе — в грунте побережья[35] В сухих почвах представители этого рода способны сохраняться в виде цист до 24 лет.[36]
Также представители рода Azotobacter были выделены из водных местообитаний, в том числе из пресноводных водоёмов[37], солоноватоводных болот[38]. Некоторые представители рода Azotobacter ассоциированы с растениями и обнаружены в ризосфере, вступая с растением в определённые взаимоотношения[39] — представители рода были выделены из ризосферы мангровых деревьев совместно с другими азотфиксирующими и денитрифицирующими бактериями[40].
Некоторые штаммы также обнаружены в коконах дождевых червей Eisenia fetida.[41]
Фиксация азота
Представители рода Azotobacter являются свободноживущими азотфиксаторами, то есть в отличие от представителей рода Rhizobium фиксируют молекулярный азот из атмосферы, не вступая в симбиотические отношения с растениями, хотя некоторые представители рода вступают в ассоциацию с растением-хозяином.[42] Фиксация азота ингибируется наличием доступных источников азота, например ионов аммония, нитратов.[43]
Представители рода Azotobacter имеют полный комплекс ферментов, необходимый для осуществления азотфиксации: ферредоксины, гидрогеназы и важнейший фермент — нитрогеназу. Процесс азотфиксации энергозависим и требует притока энергии в виде АТФ. Процесс фиксации азота крайне чувствителен к присутствию кислорода, поэтому у представителей рода Azotobacter выработался особый механизм защиты от действия кислорода — так называемая дыхательная защита, осуществляемая путём значительной интенсификации дыхания, снижающего концентрацию кислорода в клетках.[44] Также имеется особый белок Shethna, защищающий нитрогеназу и участвующий в предотвращении гибели клетки, вызванной кислородом: мутанты, не вырабатывающие этот белок, гибнут в присутствии кислорода во время азотфиксации в отсутствие источника азота в среде[45] Определённую роль в процессах азотфиксации у Azotobacter играют гомоцитрат-ионы.[46]
Нитрогеназы
Нитрогеназный комплекс является важнейшим ферментом, участвующим в азотфиксации. У представителей рода Azotobacter обнаружено несколько типов нитрогеназ — Mo-Fe-нитрогеназа[47] и альтернативные нитрогеназы: Ванадий-содержащая, не зависимая от ионов молибдена[48][49][50], более активная чем Mo-Fe-нитрогеназа в условиях пониженных температур — так, эффективная фиксация азота не прекращалась V-нитрогеназой вплоть до понижения температуры до 5 °C, активность V-нитрогеназы понижалась при понижении температуры в 10 раз меньше, чем у Mo-Fe-нитрогеназы[51], и Fe-содержащая, менее активная, чем обычная нитрогеназа[52][53]. Важную роль в образовании активной нитрогеназы играет созревание Р-кластера Mo-Fe-нитрогеназы[54], также как и предшественник Mo-Fe-кофактора нитрогеназы[55], шаперон GroEL, играет важную роль в завершающей перестройке нитрогеназы[56]. Регуляция активности нитрогеназы может осуществляться образованием осадка аргинина[57] Синтез нитрогеназы осуществляется под контролем т. н. nif-генов.[58] Фиксация азота регулируется nifLA опероном, продукт NifA регулирует транскрипцию nif-генов, NifL имеет антагонистичное действие по отношению к действию NifA в ответ на поглощённый азот и в зависимости от уровня поступления кислорода в клетку, экспрессия nifLA оперона регулируется по механизму позитивной регуляции.[59] NifL является флавопротеином, модулирующим активацию транскрипции генов азотфиксации путём редокс-зависимого переключения.[60] Двухкомпонентная система регуляции, состоящая из двух белков (энхансера NifA и сенсора NifL), образующих комплексы между собой, является атипичной и не распространённой среди других организмов системой регуляции экспрессии генов.[61]
Значение
Азотфиксация играет большую роль в круговороте азота в природе. Азотфиксация является важнейшим источником азота, и представители рода Azotobacter играют важнейшую роль в круговороте азота почвы, осуществляя фиксацию молекулярного азота. Также представители рода синтезируют некоторые биологически активные вещества, в том числе и некоторые фитогормоны, например ауксины[62], тем самым стимулируя рост и развитие растений[63], являясь биологическим стимулятором роста растений и синтезируя факторы, необходимые для роста растений[64]. Экзополисахариды представителей рода способствуют мобилизации тяжёлых металлов в почве, способствуя самоочищению почв, загрязнённых тяжёлыми металлами, например кадмием, ртутью и свинцом.[65] Некоторые представители рода Azotobacter также способны к биодеградации некоторых хлорсодержащих ароматических соединений, например 2,4,6-трихлорфенола (2,4,6-Трихлорфенол (англ.)) — ранее использовавшегося инсектицида, фунгицида и гербицида, имеющего мутагенное и канцерогенное действие и являющегося ксенобиотиком и поллютантом.[66]
Использование человеком
Благодаря своей способности фиксировать молекулярный азот, тем самым повышая плодородие почвы и стимулирования роста растений представители рода Azotobacter используются в сельском хозяйстве[67] для получения азотных биоудобрений, в том числе азотобактерина[68], также представители рода являются продуцентами полисахарида — альгиновой кислоты (E400)[69][70][71], использующегося в медицине (в качестве антацида), в пищевой промышленности (в качестве пищевой добавки к мороженому, пудингам и кремам) и в биосорбции металлов[72] и поли(3-гидроксибутирата) (Полигидроксибутират (англ.))[73]. Azotobacter beijerinckii является продуцентом рестриктазы Abe I, узнающей несимметричную гептануклеотидную последовательность CCTCAGC.[74]
Систематика
Род Azotobacter был описан в 1901 году голландским микробиологом и ботаником, одним из основоположников экологической микробиологии Мартином Бейеринком на основании впервые выделенного и описанного им Azotobacter chroococcum, первого аэробного свободноживущего азотфиксатора.[75]

В 1903 году Липман (Lipman) описал Azotobacter vinelandii Lipman, 1903, а годом позже Azotobacter beijerinckii Lipman, 1904, названный им в честь самого Мартина Бейеринка. В 1949 году русский микробиолог Николай Александрович Красильников описал вид Azotobacter nigricans Krasil'nikov, 1949, в 1981 году разделённый Томпсоном (Thompson) и Скирманом (Skerman) на два подвида: Azotobacter nigricans subsp. nigricans Krasil'nikov, 1949 и Azotobacter nigricans subsp. achromogenes Thompson and Skerman, 1981, в том же году Томпсон и Скирман описали вид Azotobacter armeniacus Thompson and Skerman, 1981. В 1991 Пейдж (Page) и Шивпрасад (Shivprasad) описали микроаэрофильный, зависимый от ионов натрия аэротолерантный вид Azotobacter salinestris Page and Shivprasad 1991.[76]
Ранее представители рода принадлежали к семейству Azotobacteraceae Pribram, 1933, но затем были перенесены в семейство Pseudomonadaceae на основании изучения нуклеотидных последовательностей 16S рРНК. В 2004 году было проведено филогенетическое исследование и выяснено, что Azotobacter vinelandii входит в одну кладу с бактерией Pseudomonas aeruginosa.[77] В 2007 году было сделано предположение о близости родов Azotobacter, Azomonas и Pseudomonas и о возможной синонимичности.[78]
- Таксономическая схема
царство Бактерии тип Протеобактерии ещё более двадцати типов, в том числе Актиномицеты, Цианобактерии, Aquificae, Chloroflexi, Dictyoglomi класс Gamma Proteobacteria классы Alpha Proteobacteria (семейство Риккетсии и др.), Beta Proteobacteria (род Neisseria и др.), Delta Proteobacteria (роды Bdellovibrio, Desulfovibrio и др.), Epsilon Proteobacteria порядок Pseudomonadales ещё около пятнадцати порядков, в том числе Enterobacteriales (роды Иерсиния, Сальмонелла, Эрвиния и др.), Oceanospirillales (род Alcanivorax и др.), Pasteurellales (Гемофильная палочка и др.) семейство Pseudomonadaceae семейство Moraxellaceae род Азотобактер ещё около пятнадцати родов шесть видов К роду Azotobacter ранее принадлежали также виды Azotobacter agilis (перенесён в 1938 году Виноградским в род Azomonas), Azotobacter macrocytogenes (перенесён в 1981 году в род Azomonotrichon и в 1982 году в род Azomonas) и Azotobacter paspali (перенесён в 1981 году в род Azorhizophilus).
См. также
Примечания
- ↑ Gandora V., Gupta R. D., Bhardwaj K. K. R. Abundance of Azotobacter in great soil groups of North-West Himalayas // Journal of the Indian Society of Soil Science. — 1998. — Т. 46. — № 3. — С. 379—383. — ISSN 0019-638X. ISSN 0019-638X CODEN JINSA4
- ↑ Martyniuk S., Martyniuk M. Occurrence of Azotobacter Spp. in Some Polish Soils // Polish Journal of Environmental Studies. — 2003. — Т. 12. — № 3. — С. 371—374.
- ↑ Tejera N., Lluch C., Martínez-Toledo M. V., González-López J. Isolation and characterization of Azotobacter and Azospirillum strains from the sugarcane rhizosphere // Plant and Soil. — 2005. — Т. 270. — № 1—2. — С. 223—232. — ISSN 0032-079X. ISSN 0032-079X
- ↑ Kumar R., Bhatia R., Kukreja K., Behl R. K., Dudeja S. S., Narula N. Establishment of Azotobacter on plant roots: chemotactic response, development and analysis of root exudates of cotton (Gossypium hirsutum L.) and wheat (Triticum aestivum L.) // Journal of Basic Microbiology. — 2007. — Т. 47. — № 5. — С. 436—439.
- ↑ Baillie A., Hodgkiss W., Norris J. R. Flagellation of Azotobacter spp. as Demonstrated by Electron Microscopy // Journal of Applied Microbiology. — 1962. — Т. 25. — № 1. — С. 116—119.
- ↑ Vela G. R., Rosenthal R. S. Effect of Peptone on Azotobacter Morphology // Journal of Bacteriology. — 1972. — Т. 111. — № 1. — С. 260—266.
- ↑ Jones D. H. Further Studies on the Growth Cycle of Azotobacter // Journal of Bacteriology. — 1920. — Т. 5. — № 4. — С. 325—341.
- ↑ Lewis I. M. The cytology of bacteria // Bacteriological Reviews. — 1941. — Т. 5. — № 3. — С. 181–230.
- ↑ Lewis I. M. Cell Inclusions and the Life Cycle of Azotobacter // Journal of Bacteriology. — 1937. — Т. 34. — № 2. — С. 191–205.
- ↑ Socolofsky M. D., Wyss O. Resistance of the Azotobacter Cyst // Journal of Bacteriology. — 1962. — Т. 84. — С. 119—124.
- ↑ Layne J. S., Johnson E. J. Natural Factors Involved in the Induction of Cyst Formation in Azotobacter // Journal of Bacteriology. — 1964. — Т. 87. — № 3. — С. 684—689.
- ↑ Sadoff H. L. Encystment and Germination in Azotobacter vinelandii1 // Microbiological Reviews. — 1975. — Т. 39. — № 4. — С. 516—539.
- ↑ Gama-Castro S., Núñez C., Segura D. , Moreno S., Guzmán J., and Espín G. Azotobacter vinelandii Aldehyde Dehydrogenase Regulated by ς54: Role in Alcohol Catabolism and Encystment // Journal of Bacteriology. — 2001. — Т. 183. — № 21. — С. 6169—6174.
- ↑ Núñez C., Moreno S., Soberón-Chávez G., Espín G. The Azotobacter vinelandii Response Regulator AlgR Is Essential for Cyst Formation // Journal of Bacteriology. — 1999. — Т. 181. — № 1. — С. 141–148.
- ↑ Pope L. M., Wyss O. Outer Layers of the Azotobacter vinelandii Cyst // Journal of Bacteriology. — 1970. — Т. 102. — № 1. — С. 234—239.
- ↑ Page W. J., Sadoff H. L. Relationship Between Calcium and Uronic Acids in the Encystment of Azotobacter vinelandiil // Journal of Bacteriology. — 1975. — Т. 122. — № 1. — С. 145—151.
- ↑ Lin L. P., Sadoff H. L. Preparation and Ultrastructure of the Outer Coats of Azotobacter vinelandii Cysts // Journal of Bacteriology. — 1969. — Т. 98. — № 3. — С. 1335—1341.
- ↑ Parker L. T., Socolofsky M. D. Central Body of the Azotobacter Cyst // Journal of Bacteriology. — 1968. — Т. 91. — № 1. — С. 297—303.
- ↑ Funa N., Ozawa H., Hirata A., Horinouchi S. Phenolic lipid synthesis by type III polyketide synthases is essential for cyst formation in Azotobacter vinelandii // Proceedings of the National Academy of Sciences of the United States of America : Сб.. — 2006. — Т. 103. — № 16. — С. 6356–6361.
- ↑ Wyss O., Neumann M. G., Socolofsky M. D. Development and germination of the Azotobacter cyst // Journal of Biophysical and Biochemical Cytology. — 1961. — № 10. — С. 555—565.
- ↑ Loperfido B., Sadoff H. L. Germination of Azotobacter vinelandii Cysts: Sequence of Macromolecular Synthesis and Nitrogen Fixation // Journal of Bacteriology. — 1973. — Т. 112. — № 2. — С. 841–846.
- ↑ Lin L. P., Pankratz S., Sadoff H. L. Ultrastructural and physiological changes occurring upon germination and outgrowth of Azotobacter vinelandii cysts // Journal of Bacteriology. — 1978. — Т. 135. — № 2. — С. 641–646.
- ↑ Part B: The Gammaproteobacteria // Bergey's Manual of Systematic Bacteriology / Editor-in-Chief: George M. Garrity. — 2nd Edition. — New York: Springer, 2005. — Т. The Proteobacteria. — 2816 p. — ISBN 0-387-95040-0
- ↑ Wong T.-Y., Maier R. J. H2-Dependent Mixotrophic Growth of N2-Fixing Azotobacter vinelandii // Journal of Bacteriology. — 1985. — Т. 163. — № 2. — С. 528–533.
- ↑ Большой практикум по микробиологии / Под общей ред. проф. Г. Л. Селибера. — М.: Высшая школа, 1962. — С. 190—191.
- ↑ Теппер Е. З., Шильникова В. К., Переверзева Г. И. Практикум по микробиологии. — 2-е изд., перераб. и доп. — М.: Колос, 1979. — 216 с.
- ↑ Shivprasad S., Page W. J. Catechol Formation and Melanization by Na+-Dependent Azotobacter chroococcum: a Protective Mechanism for Aeroadaptation? // Applied and Environmental Microbiology. — 1989. — Т. 55. — № 7. — С. 1811–1817.
- ↑ Jensen H. L. The Azotobacteriaceae // Bacteriological Reviews. — 1954. — Т. 18. — № 4. — С. 195–214.
- ↑ Johnstone D. B. Azotobacter Fluorescence // Journal of Bacteriology. — 1955. — Т. 69. — № 4. — С. 481–482.
- ↑ Genome Result
- ↑ Maldonado R., Jimenez J., Casadesus J. Changes of Ploidy during the Azotobacter vinelandii Growth Cycle // Journal of Bacteriology. — 1994. — Т. 176. — № 13. — С. 3911—3919.
- ↑ Maia M., Sanchez J. M., Vela G. R. Plasmids of Azotobacter vinelandii // Journal of Bacteriology. — 1988. — Т. 170. — № 4. — С. 1984—1985.
- ↑ Glick B. R., Brooks H. E., Pasternak J. J. Transformation of Azotobacter vinelandii with Plasmid DNA // Journal of Bacteriology. — 1985. — Т. 162. — № 1. — С. 276—279.
- ↑ Yamagata U., Itano A. Physiological Study of Azotobacter chroococcum, beijerinckii and vinelandii types // Journal of Bacteriology. — 1923. — Т. 8. — № 6. — С. 521—531.
- ↑ Boyd W. L., Boyd J. W. Presence of Azotobacter species in Polar Regions // Journal of Bacteriology. — 1962. — Т. 83. — № 2. — С. 429–430.
- ↑ Moreno J., Gonzalez-Lopez J., Vela G. R. Survival of Azotobacter spp. in Dry Soils // Applied and Environmental Microbiology. — 1986. — Т. 51. — № 1. — С. 123—125.
- ↑ Johnstone D. B. Isolation of Azotobacter Insignis From Fresh Water // Ecology. — 1967. — Т. 48. — № 4. — С. 671—672.
- ↑ Dicker H. J., Smith D. W. Enumeration and Relative Importance of Acetylene-Reducing (Nitrogen-Fixing) Bacteria in a Delaware Salt Marsh // Applied and Environmental Microbiology. — 1980. — Т. 39. — № 5. — С. 1019—1025.
- ↑ van Berkum P., Bohlool B. Evaluation of Nitrogen Fixation by Bacteria in Association with Roots of Tropical Grasses // Microbiological Reviews. — 1980. — Т. 44. — № 3. — С. 491—517.
- ↑ Flores-Mireles A. L., Winans S. C., Holguin G. Molecular Characterization of Diazotrophic and Denitrifying Bacteria Associated with Mangrove Roots // Applied and Environmental Microbiology. — 2007. — Т. 73. — № 22. — С. 7308–7321.
- ↑ Zachmann J. E., Molina J. A. E. Presence of Culturable Bacteria in Cocoons of the Earthworm Eisenia fetida // Applied and Environmental Microbiology. — 1993. — Т. 59. — № 6. — С. 1904—1910.
- ↑ Kass D. L., Drosdoff M., Alexander M. Nitrogen Fixation by Azotobacter paspali in Association with Bahiagrass (Paspalum notatum) // Soil Science Society of America Journal. — 1971. — № 35. — С. 286—289.
- ↑ Bürgmann H., Widmer F., Sigler W. V, Zeyer J. mRNA Extraction and Reverse Transcription-PCR Protocol for Detection of nifH Gene Expression by Azotobacter vinelandii in Soil // Applied and Environmental Microbiology. — 2003. — Т. 69. — № 4. — С. 1928—1935.
- ↑ Берцова Ю. В., Демин О. В., Богачев А. В. Дыхательная Защита Нитрогеназного Комплекса у Azotobacter vinelandii // Успехи биологической химии : Сб.. — 2005. — Т. 45. — С. 205—234.
- ↑ Maier R. J., Moshiri F. Role of the Azotobacter vinelandii Nitrogenase-Protective Shethna Protein in Preventing Oxygen-Mediated Cell Death // Journal of Bacteriology. — 2000. — Т. 182. — № 13. — С. 3854—3857.
- ↑ Durrant M. C., Francis A., Lowe D. J., Newton W. E., Fisher K. Evidence for a dynamic role for homocitrate during nitrogen fixation: the effect of substitution at the α-Lys426 position in MoFe-protein of Azotobacter vinelandii // Biochemistry Journal. — 2006. — Т. 397. — № 2. — С. 261–270.
- ↑ Howard J. B., Rees D. C. How many metals does it take to fix N2? A mechanistic overview of biological nitrogen fixation // Proceedings of the National Academy of Sciences of the United States of America. — 2006. — Т. 103. — № 46. — С. 17088–17093.
- ↑ Bellenger J. P., Wichard T., Kraepiel A. M. L. Vanadium Requirements and Uptake Kinetics in the Dinitrogen-Fixing Bacterium Azotobacter vinelandii // Applied and Environmental Microbiology. — 2008. — Т. 74. — № 5. — С. 1478–1484.
- ↑ Rüttimann-Johnson C., Rubio L. M., Dean D. R., Ludden P. W. VnfY Is Required for Full Activity of the Vanadium-Containing Dinitrogenase in Azotobacter vinelandii // Journal of Bacteriology. — 2003. — Т. 185. — № 7. — С. 2383–2386.
- ↑ Robson R. L., Eady R. R., Richardson T. H., Miller R. W., Hawkins M., Postgate J. R. The alternative nitrogenase of Azotobacter chroococcum is a vanadium enzyme // Nature. — 1986. — № 322. — С. 388—390.
- ↑ Miller R. W., Eady R. R. Molybdenum and vanadium nitrogenases of Azotobacter chroococcum. Low temperature favours N2 reduction by vanadium nitrogenase. // Biochemistry Journal. — 1988. — Т. 256. — № 2. — С. 429–432.
- ↑ Fallik E., Chan Y.-K., Robson R. L. Detection of Alternative Nitrogenases in Aerobic Gram-Negative Nitrogen-Fixing Bacteria // Journal of Bacteriology. — 1991. — Т. 173. — № 1. — С. 365—371.
- ↑ Pau R. N., Mitchenall L. A., Robson R. L. Genetic evidence for an Azotobacter vinelandii nitrogenase lacking molybdenum and vanadium // Journal of Bacteriology. — 1989. — Т. 171. — № 1. — С. 124–129.
- ↑ Hu Y., Fay A. W., Lee C. C., Ribbe M. W. P-cluster maturation on nitrogenase MoFe protein // Proceedings of the National Academy of Sciences of the United States of America. — 2007. — Т. 104. — № 25. — С. 10424–10429.
- ↑ Hu Y., Fay A. W., Lee C. C., Ribbe M. W. Identification of a nitrogenase FeMo cofactor precursor on NifEN complex // Proceedings of the National Academy of Sciences of the United States of America. — 2005. — Т. 102. — № 9. — С. 3236—3241.
- ↑ Ribbe M. W., Burgess B. K. The chaperone GroEL is required for the final assembly of the molybdenum-iron protein of nitrogenase // Proceedings of the National Academy of Sciences of the United States of America. — 2001. — Т. 98. — № 10. — С. 5521—5525.
- ↑ Martinez-Argudo I., Little R., Dixon R. A crucial arginine residue is required for a conformational switch in NifL to regulate nitrogen fixation in Azotobacter vinelandii // Proceedings of the National Academy of Sciences of the United States of America. — 2004. — Т. 101. — № 46. — С. 16316—16321.
- ↑ Curatti L., Brown C. S., Ludden P. W., Rubio L. M. Genes required for rapid expression of nitrogenase activity in Azotobacter vinelandii // Proceedings of the National Academy of Sciences of the United States of America. — 2005. — Т. 102. — № 18. — С. 6291—6296.
- ↑ Mitra R., Das H. K., Dixit A. Identification of a Positive Transcription Regulatory Element within the Coding Region of the nifLA Operon in Azotobacter vinelandii // Applied and Environmental Microbiology. — 2005. — Т. 71. — № 7. — С. 3716—3724..
- ↑ Hill S., Austin S., Eydmann T., Jones T., Dixon R. Azotobacter vinelandii NIFL is a flavoprotein that modulates transcriptional activation of nitrogen-fixation genes via a redox-sensitive switch. // Proceedings of the National Academy of Sciences of the United States of America. — 1996. — Т. 93. — № 5. — С. 2143—2148.
- ↑ Money T., Barrett J., Dixon R., Austin S. Protein-Protein Interactions in the Complex between the Enhancer Binding Protein NIFA and the Sensor NIFL from Azotobacter vinelandii // Journal of Bacteriology. — 2001. — Т. 183. — № 4. — С. 1359—1368.
- ↑ Ahmad F., Ahmad I., Khan M. S. Indole Acetic Acid Production by the Indigenous Isolates of Azotobacter and Fluorescent Pseudomonas in the Presence and Absence of Tryptophan // Turkish Journal of Biology. — 2005. — № 29. — С. 29—34.
- ↑ Oblisami G., Santhanakrishan P., Pappiah C. M., Shabnugavelu K. G. Effect of Azotobacter Inoculant And Growth Regulators on the Growth of Cashew // Acta Horticulturae (ISHS). — № 108. — С. 44—49.
- ↑ Rajaee S., Alikhani H. A., Raiesi F. Effect of Plant Growth Promoting Potentials of Azotobacter chroococcum Native Strains on Growth, Yield and Uptake of Nutrients in Wheat // Journal of Science and Technology of Agriculture and Natural Resources. — 2007. — Т. 11. — № 41. — С. 297.
- ↑ Chen J. H., Czajka D. R., Lion L. W., Shuler M. L., Ghiorse W. C. Trace metal mobilization in soil by bacterial polymers. // Environmental Health Perspectives. — 1995. — Т. 103. — № 1. — С. 53—58.
- ↑ Li D. Y., Eberspächer J., Wagner B., Kuntzer J., Lingens F. Degradation of 2,4,6-trichlorophenol by Azotobacter sp. strain GP1 // Applied and Environmental Microbiology. — 1991. — Т. 57. — № 7. — С. 1920—1928.
- ↑ Azotobacter in Sustainable Agriculture / edited by Neeru Narula. — New Delhi, 2000. — 162 p. — ISBN 81-239-0661-7
- ↑ Волова Т. Г. 6.3. Биологические удобрения // Биотехнология / Под ред. академика И. И. Гительзона. — Новосибирск: Издательство СО РАН, 1999. — С. 190—193. — ISBN 5-7692-0204-1
- ↑ Galindo E., Peña C., Núñez C., Segura D., Espín G. Molecular and bioengineering strategies to improve alginate and polydydroxyalkanoate production by Azotobacter vinelandii // Microbial Cell Factories. — 2007. — Т. 6. — № 7.
- ↑ Page W. J., Tindale A., Chandra M., Kwon E. Alginate formation in Azotobacter vinelandii UWD during stationary phase and the turnover of poly-ß-hydroxybutyrate // Microbiology. — 2001. — № 147. — С. 483—490.
- ↑ Ahmed M., Ahmed N. Genetics of Bacterial Alginate: Alginate Genes Distribution, Organization and Biosynthesis in Bacteria // Current Genomics. — 2007. — Т. 8. — № 3. — С. 191–202.
- ↑ Emtiazia G., Ethemadifara Z., Habibib M. H. Production of extra-cellular polymer in Azotobacter and biosorption of metal by exopolymer // African Journal of Biotechnology. — 2004. — Т. 3. — № 6. — С. 330—333.
- ↑ Pettinari M. J., Vázquez G. J., Silberschmidt D., Rehm B., Steinbüchel A., Méndez B. S. Poly(3-Hydroxybutyrate) Synthesis Genes in Azotobacter sp. Strain FA8 // Applied and Environmental Microbiology. — 2001. — Т. 67. — № 11. — С. 5331—5334.
- ↑ Vitkute J., Maneliene Z., Janulaitis A. Abe I, a restriction endonuclease from Azotobacter beijerinckii, which recognizes the asymmetric heptanucleotide sequence 5[prime-CCTCAGC-3[prime](-/-2)] // Nucleic Acids Research. — 1998. — Т. 26. — № 21. — С. 4917—4918.
- ↑ Beijerinck M. W. Ueber Oligonitrophile Mikroben // Zentralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten und Hygiene. Abteilung II. — 1901. — № 7. — С. 561—582.
- ↑ Page W. J., Shivprasad S. Azotobacter salinestris sp. nov., a sodium-dependent, microaerophilic, and aeroadaptive nitrogen-fixing bacterium // International Journal of Systematic Bacteriology. — 1991. — Т. 41. — № 3. — С. 369—376.
- ↑ Rediers H., Vanderleyden J., De Mot R. MICROBIOLOGY COMMENT Azotobacter vinelandii: a Pseudomonas in disguise? // Microbiology. — 2004. — № 150. — С. 1117—1119.
- ↑ Young J. M., Park D.-C. Probable synonymy of the nitrogen-fixing genus Azotobacter and the genus Pseudomonas // International Journal of Systematic and Evolutionary Microbiology. — 2007. — № 57. — С. 2894—2901.
Ссылки
- Азотобактер — статья из Большой советской энциклопедии (Проверено 11 апреля 2011)
- Azotobacter (англ.). MicrobeWiki. — The student-edited microbiology resource. Архивировано из первоисточника 20 августа 2011. Проверено 13 сентября 2008.
- J. P. Euzéby. Azotobacter Beijerinck 1901 (англ.). List of Prokaryotic names with Standing in Nomenclature. Архивировано из первоисточника 20 августа 2011. Проверено 13 сентября 2008.
- Azotobacter.org (англ.). — Сайт проекта по исследованию генома Azotobacter vinelandii. Архивировано из первоисточника 20 августа 2011. Проверено 13 сентября 2008.
- Amy Crum. Azotbacter (англ.). SOIL MICROBIOLOGY BIOL/CSES 4684. Архивировано из первоисточника 23 января 2012. Проверено 13 сентября 2008.
- Azotobacter vinelandii (англ.). John Innes Centre — Molecular Microbiology Department. Архивировано из первоисточника 20 августа 2011. Проверено 13 сентября 2008.
- Azotobacter vinelandii (англ.). JGI. Архивировано из первоисточника 20 августа 2011. Проверено 13 сентября 2008.
- Iwao WATANABE (JICA/Cantho Univ. expert Mar-Apr. 2000). Biological Nitrogen Fixation and its Use in Agriculture (англ.). Lecture in Cantho University, Vietnam (30 марта 2000). Архивировано из первоисточника 20 августа 2011. Проверено 13 сентября 2008.
- Azotobacter (англ.). Microbiology Video Library. MicrobiologyBytes. Архивировано из первоисточника 20 августа 2011. Проверено 13 сентября 2008.
Эта статья входит в число избранных статей русскоязычного раздела Википедии. Категории:- Бактерии по алфавиту
- Бактерии семейства Pseudomonadaceae
Wikimedia Foundation. 2010.