- Термодинамическая фаза
-
Фазовые переходы 
Статья является частью серии «Термодинамика». Понятие фазы Равновесие фаз Квантовый фазовый переход Разделы термодинамики Начала термодинамики Уравнение состояния Термодинамические величины Термодинамические потенциалы Термодинамические циклы Фазовые переходы править См. также «Физический портал» Термодинами́ческая фа́за — термодинамически однородная по свойствам часть термодинамической системы, отделенная от других фаз поверхностями раздела, на которых скачком изменяются некоторые свойства системы. Другое определение: Фаза — гомогенная часть гетерогенной системы. В однокомпонентной системе разные фазы могут быть представлены различными агрегатными состояниями или разными полиморфными модификациями вещества. В многокомпонентной системе фазы могут иметь различный состав и структуру. В любом случае при наличии раздела фаз подразумевается принципиальная возможность перехода вещества из одной фазы в другую.
Содержание
Основные понятия
Газ всегда состоит из одной фазы, жидкость может состоять из нескольких жидких фаз разного состава (Ликвация, жидкостная несмешиваемость), но двух разных жидкостей одного состава в равновесии сосуществовать не может. Вещество в твердом состоянии может состоять из нескольких фаз, причем некоторые из них могут иметь одинаковый состав, но различную структуру (полиморфные модификации, аллотропия).
Разные фазы обладают различными вариантами упаковки молекул (для кристаллических фаз, различными кристаллическими решетками), и, следовательно, своими характерными значениями коэффициента сжимаемости, коэффициента теплового расширения и прочими характеристиками. Кроме того, различные фазы могут обладать разными электрическими (сегнетоэлектрики), магнитными (ферромагнетики), и оптическими свойствами (например, твёрдый кислород).
Термодинамические фазы на фазовой диаграмме
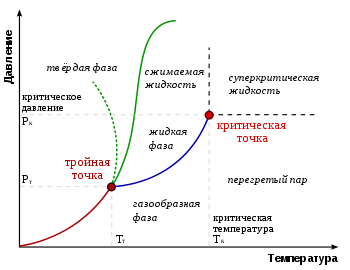 Типичные виды фазовых диаграмм. Зелёная линия из точек показывает аномальное поведение воды
Типичные виды фазовых диаграмм. Зелёная линия из точек показывает аномальное поведение воды
На фазовой диаграмме вещества различные термодинамические фазы занимают определённые области. Линии, разделяющие различные термодинамические фазы, называются линиями фазового перехода. Если вещество находится в условиях, отвечающих точке внутри какой-либо области, то оно полностью находится в этой термодинамической фазе. Если же состояние вещества отвечает точке на одной из линий фазовых переходов, то вещество в термодинамическом равновесии может находиться частично в одной, а частично в другой фазе. Пропорция двух фаз определяется, как правило, полной энергией, запасённой системой.
При медленном изменении давления или температуры вещество описывается движущейся точкой на фазовой диаграмме. Если эта точка в своём движении пересекает одну из линий, разделяющих термодинамические фазы, происходит фазовый переход, при котором физические свойства вещества меняются скачкообразно.
Не все фазы полностью отделены друг от друга линией фазового перехода. В некоторых случаях эта линия может обрываться, оканчиваясь критической точкой. В этом случае возможен постепенный, а не скачкообразный переход из одной фазы в другую, в обход линии фазовых переходов.
Точка на фазовой диаграмме, где сходятся три линии фазовых переходов, называется тройной точкой. Обычно под тройной точкой вещества подразумевается частный случай, когда сходятся линии плавления, кипения и сублимации, однако на достаточно богатых фазовых диаграммах может быть несколько тройных точек. Вещество в тройной точке в состоянии термодинамического равновесия может частично находиться во всех трёх фазах. На многомерных фазовых диаграммах (то есть если кроме температуры и давления присутствуют иные интенсивные величины) могут существовать четверные и т. д. точки.
Термодинамические фазы и агрегатные состояния вещества
Набор термодинамических фаз вещества обычно значительно богаче набора агрегатных состояний, то есть одно и то же агрегатное состояние вещества может находиться в различных термодинамических фазах. Именно поэтому описание вещества в терминах агрегатных состояний довольно огрублённое, и оно не может различить некоторые физические разные ситуации.
Богатый набор термодинамических фаз связан, как правило, с различными вариантами порядка, которые допускаются в том или ином агрегатном состоянии.
- В газообразном состоянии вещество не обладает никаким порядком. Соответственно, в газообразном состоянии любое вещество обладает только одной термодинамической фазой. (Фазовые переходы типа диссоциации молекул или ионизации являются, по определению, переходами одного вещества в другое).
- Жидкость обладает ориентационным порядком, но, как правило, не обладает трансляционным порядком . В результате у одной и той же жидкости могут быть разные термодинамические фазы, однако количество их редко превышает единицу. Так, например, существование новой жидкой фазы обнаружено в переохлаждённой воде. Другой, специфический, пример: сверхтекучее состояние в жидком гелии.
- Кристаллическое твёрдое тело обладает как трансляционным, так и ориентационным порядком. В результате даже возникает большое число возможных вариантов ориентации соседних молекул друг относительно друга, которые могут оказаться энергетически выгодными при тех или иных давлении и температуре. В результате твёрдые тела обладают, как правило, достаточно сложной фазовой диаграммой. Например, фазовая диаграмма такого, казалось бы, простого вещества, как лёд, насчитывает по крайней мере 12 термодинамических фаз, реализующихся при различных температурах и давлениях.
Выделение фаз
Выделение фаз — превращение гомогенной системы в двухфазную (или с числом фаз более двух) широко используется в науке и технике.
Кристаллизация позволяет получать чистые вещества.
При высоких давлениях может наблюдаться такое явление, как расслоение в системе газ — газ. На возможность существования гетерогенного равновесия в газовой смеси выше критической температуры было указано ещё Ван-дер-Ваальсом и затем она была проанализирована Камерлинг-Оннесом и Кеезомом. Экспериментальное доказательство наличия такого явления было впервые получено на примере системы аммиак — азот в 1941 г. Вначале предполагалось, что ограниченная взаимная растворимость наблюдается лишь в газовых смесях, содержащих полярный компонент (аммиак, сероводород). Однако впоследствии было установлено расслоение смесей гелий — диоксид углерода, гелий — этилен и гелий — пропан. В системе гелий — этилен существование поверхности раздела фаз при ограниченной взаимной растворимости газов было подтверждено визуальными наблюдениями и фотографированием мениска между двумя газовыми фазами. При расслоении смеси газов иногда наблюдается так называемое баротропное явление — перемена местами двух сосуществующих фаз при увеличении давления. К примеру, в двойной системе NH3(ж.) — N2(г.) фаза, более богатая аммиаком имеет большую плотность. Однако при расслоении смеси (90 °C, 1800 ат (~1,84 кбар)) фаза, более богатая аммиаком имеет уже меньшую плотность и поднимается вверх.[1]
См. также
- Правило фаз
- Переохлаждение
- Перегрев
- Phase-change Dual — технология записи оптических дисков, основанная на двойной смене фазового состояния вещества.
Примечания
- ↑ Гоникберг М. Г. Химическое равновесие и скорость реакций при высоких давлениях.// М.: Изд. АН СССР, 1960 г., c. 19 — 24
Ссылки
- Французские физики обнаружили систему, обратимо твердеющую при повышении температуры — α-циклодекстрин, вода, и 4-метилпиридин
Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Термодинамические состояния вещества Твёрдое тело Жидкость Газ Плазма Электромагнитная • Кварк-глюонная • Глазма
См. также Сверхкритическая жидкость • Вырожденный газ • Конденсат Бозе — Эйнштейна • Странная материя • Кривая охлаждения • Твёрдый гелий (λ-точка) • Квантовая жидкость (Сверхтекучесть • Сверхтекучее твёрдое тело) • Дисперсная система (Раствор • Коллоидные • Грубодисперсная • Свободнодисперсная коллоидная (Дым • Золи)) • Термодинамическая фаза • Фазовый переход • Нормальные и стандартные условия • Статистика Ферми — Дирака • Уравнение состояния • Теория катастроф
Категории:- Термодинамика
- Фазовые переходы
Wikimedia Foundation. 2010.
