- Хлорат калия
-
Хлорат калия 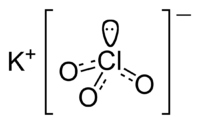
Общие Систематическое наименование Хлорат калия Химическая формула KClO3 Физические свойства Состояние (ст. усл.) Бесцветные кристаллы Отн. молек. масса 122.55 а. е. м. Молярная масса 122.55 г/моль Плотность 2,32 г/см³ Термические свойства Температура плавления 356 °C Температура разложения ~ 400 °C Энтальпия образования (ст. усл.) -391,204 кДж/моль Химические свойства Растворимость в воде при 0°C 3,25 г/100 мл Растворимость в воде при 20°C 7,3 г/100 мл Растворимость в воде при 100°C 56,2 г/100 мл Растворимость в воде при 104,2°C 61,5 г/100 мл Классификация Рег. номер CAS [3811-04-9] Хлорат калия (бертолетова соль) — KClO3, калиевая соль хлорноватой кислоты (HClO3).
Содержание
История
Впервые получен Клодом Бертолле в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
Получение
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующиеся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, диспропорционирующего далее на хлорат калия и исходный хлорид калия.
Химические свойства
При температуре ~ 400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
-
 (400 °C);
(400 °C); (550—620 °C)
(550—620 °C)
В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200 °C).
-
 (150—300 °C, кат. MnO2)
(150—300 °C, кат. MnO2)
Применение
Взрывчатые вещества
Смеси хлората калия с восстановителями (фосфором, серой, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов, входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, терочный состав ручных гранат вермахта).
В медицине
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода
В начале XX века использовалась для лабораторных экспериментов — получения кислорода, но из-за высокой опасности её перестали применять.
Для получения диоксида хлора
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
 Категории:
Категории:- Соединения калия
- Хлораты
- Взрывчатые вещества
-
Wikimedia Foundation. 2010.






