- Сульфат серебра
-
Сульфат серебра Систематическое название Сульфат серебра(I)
Химическая формула Ag2SO4
Внешний вид белые кристаллы
Свойства Молярная масса Температура плавления 660 °C (933.15 К)
Температура разложения 750—1100 °C
Фазовые переходы 427 °C
(ромб. → гекс.)Плотность 5,45 г/см³
Растворимость в воде 0,79 г/100 мл
Токсикологические данные LD50 5000 мг/кг
Структура Кристаллическая решётка Орторомбическая
Термодинамические свойства Стандартная энтальпия образования −715 кДж/моль
Энтальпия плавления +16,74 кДж/моль
Стандартная молярная энтропия +200 Дж/(К·моль)
Стандартная энергия образования Гиббса −618 кДж/моль
Классификация Регистрационный номер CAS 10294-26-5
Регистрационный номер EC Безопасность R-фразы R41
S-фразы S22; S26; S39
H-фразы H318
P-фразы P260; P280; P305 + P351 + P338; P313
Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). Сульфа́т серебра́ (сульфат серебра (I)) — неорганическое вещество с формулой Ag2SO4, соль серебра и серной кислоты.
Содержание
Физические свойства
При нормальных условиях сульфат серебра — белое кристаллическое вещество малорастворимое в воде (0,79 г/100 г H2O при 20 °C; 1,30 г/100 г H2O при 80 °C), нерастворимое в этаноле. При осаждении из водных растворов не образует кристаллогидратов.
Существует в двух кристаллических модификациях: с ромбической и гексагональной сингонией кристаллической решетки. Температура фазового перехода из ромбической формы в гексагональную 427 °C.
При 660 °C плавится без разложения.
Химические свойства
Окислительно-восстановительные реакции
При температуре 750−1100 °C сульфат серебра разлагается с выделением металлического серебра:
Также, металлическое серебро восстанавливается из сульфата при нагревании последнего в токе водорода выше 200 °C:
или при нагревании с сульфидом серебра выше 300 °C:
Обменные реакции
Сульфат серебра растворяется в концентрированном водном растворе аммиака с образованием комплекса:
При небольшом (до 50 °C) нагревании сульфат серебра растворяется в концентрированной серной кислоте:
При взаимодействии с концентрированной соляной кислотой выпадает осадок хлорида серебра:
При взаимодействии с концентрированной щёлочью выпадает осадок оксида серебра (I):
Получение
Сульфат серебра может быть получен нагреванием металлического серебра с диоксидом серы и кислородом выше 450 °C:
взаимодействием металлического серебра с горячей концентрированной серной кислотой:
осаждением из растворов в реакциях ионного обмена, например:
вытеснением концентрированной серной кислотой летучих соединений водорода из солей:
 , где
, где 
Применение
Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его.Влияние на здоровье
Сульфат серебра оказывает сильное раздражающее действие на глаза. При длительном контакте с кожей может вызывать аргирию.
LD50 5000 мг/кг.
Источники
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник. — М: Дрофа, 2006.
- Лидин Р.А., Молочко В.А., Андреева Л.Л. Реакции неорганических веществ: справочник. — М: Дрофа, 2007.
- Merck Safety Data Sheet − Silver sulfate (pdf)
СульфатыАлюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2)
Категории:- Соединения серебра
- Сульфаты
Wikimedia Foundation. 2010.

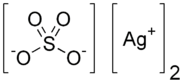




![\mathsf{Ag_2SO_4 + 4\ (NH_3 \cdot H_2O) \longrightarrow [Ag(NH_3)_2]_2SO_4 + 4\ H_2O}](50d6836c5a2c13648abd262fc46a4dea.png)





