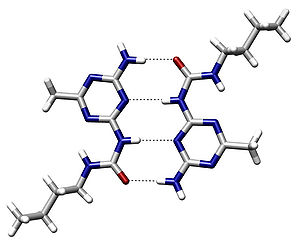
- Водородная связь
-
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1]
Содержание
Природа
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H•••BR' различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR'.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H•••[F-H•••F]-).
История
В книге The Nature of Chemical Bond and the Structure of Molecules and Crystals Лайнуса Полинга, впервые изданной в 1939 году, первое упоминание водородной связи приписывается Муру и Винмиллу. Они использовали водородную связь, чтобы обосновать факт, что у гидроокиси триметиламмония более слабая основа, чем у гидроксида тетраметиламмония.[4] Описание водородных связей в воде было сделано в 1920 году Латимером и Родебушем[5].
Свойства
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+ образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
В воде
Механизм Гротгуса
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных Н-связей до 5-6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Водные кластеры
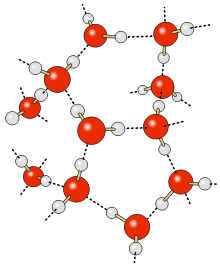 Водородная связь между молекулами воды обозначена чёрными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).
Водородная связь между молекулами воды обозначена чёрными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:
Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал/моль), что всего на порядок больше, чем характерная энергия теплового движения при температуре 300 К. В то же время энергия ковалентной O-H связи в 200 раз больше тепловой энергии. Таким образом, водородные связи относительно слабы и неустойчивы: предполагается, что они могут легко возникать и исчезать в результате тепловых флуктуаций. Это, в частности, приводит к тому, что вода должна рассматриваться не как «простая», а как «связанная жидкость»: вода представляется как сеть молекул
 , соединённых водородными связями[6].
, соединённых водородными связями[6].В нуклеиновых кислотах и белках
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах, водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК, определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
В полимерах
Много полимеров усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон, где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы) и в многих различных формах в природе, таких как древесина, хлопок и лён.
См. также
Примечания
- ↑ Определение по IUPAC
- ↑ Энергия связи H … N = 8 кДж/моль, связи H … О — около 21 кДж/моль, связи H … F около 36 кДж/моль [1]. Для сравнения, энергия ковалентной связи — 400—900 кДж/моль [2]
- ↑ Например, водородными связями обусловлена форма молекулы ДНК
- ↑ T. S. Moore and T. F. Winmill The state of amines in aqueous solution (англ.) // J. Chem. Soc.. — 1912. — Vol. 101. — P. 1635-1676. — DOI:10.1039/CT9120101635
- ↑ Wendell M. Latimer , Worth H. Rodebush POLARITY AND IONIZATION FROM THE STANDPOINT OF THE LEWIS THEORY OF VALENCE. (англ.) // J. Am. Chem. Soc.. — 1920. — Vol. 42. — P. 1419–1433. — DOI:10.1021/ja01452a015
- ↑ Dominik Marx Proton Transfer 200 Years after von Grotthuss: Insights fromAb Initio Simulations (англ.) // ChemPhysChem. — 2006. — Vol. 7. — P. 1848—1870. — DOI:10.1002/cphc.200600128
Литература
- Химическая Энциклопедия. Советская Энциклопедия, М., 1988
- В. В. Москва. Водородная связь в органической химии. Соросовский образовательный журнал, 11999,N 2, с.58-64 [3]
Химическая связь Внутримолекулярное
взаимодействиеКовалентная связь σ-связь · π-связь · δ-связь
Двойная связь · Тройная связь · Четвертная связь · Пятерная связь · Шестерная связь
3c-2e · 3c-4e · 4c-2e
Agostic связь · Bent связь · Донорно-акцепторная связь · Взаимо-обратная связь
Конъюгация · Гиперконъюгация · Ароматичность · Hapticity · АнтисвязываниеИонная связь π-Катионное взаимодействие · Солевой мостик Металлическая связь Металлическая ароматичность Межмолекулярное
взаимодействиеВодородная связь Диводородная связь · Диводородный комплекс · Низкобарьерная водородная связь · Симметричная водородная связь Нековалентная связь Силы Ван-дер-Ваальса · Дисперсионные силы · Механическая связь · Галогенная связь · Aurophilicity · Интеркаляция · Стэкинг · Энтропическая сила · Химическая полярность Категория:- Химическая связь
Wikimedia Foundation. 2010.